题目内容
能够充分说明在恒温恒容下的密闭容器中反应:2SO2+O2 2SO3,已经达到平衡的标志是
2SO3,已经达到平衡的标志是
 2SO3,已经达到平衡的标志是
2SO3,已经达到平衡的标志是| A.容器中SO2、O2、SO3共存 |
| B.容器中SO2和SO3的浓度相同 |
| C.容器中SO2、O2、SO3的物质的量为2︰1︰2 |
| D.容器中压强不随时间的变化而改变 |
D
A 错误 任何可逆反应在任何状态下反应混合物均共存;
B错误 容器中SO2和SO3的浓度是否相同,取决于反应的起始状态,此不能作为达平衡的标志;
C 错误2︰1︰2只是反应过程中反应物及生成物在反应过程中的物质的量之比,不能作为达平衡的标志;
D 正确只有容器中压强不随时间的变化而改变才说明在恒温恒容下的密闭容器中气体分子总数不变,正逆反应速率相等即反应达平衡状态。
B错误 容器中SO2和SO3的浓度是否相同,取决于反应的起始状态,此不能作为达平衡的标志;
C 错误2︰1︰2只是反应过程中反应物及生成物在反应过程中的物质的量之比,不能作为达平衡的标志;
D 正确只有容器中压强不随时间的变化而改变才说明在恒温恒容下的密闭容器中气体分子总数不变,正逆反应速率相等即反应达平衡状态。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2Z ,达到平衡后, X的转化率不可能为
2Z ,达到平衡后, X的转化率不可能为 2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 。请根据图示回答下列问题:
。请根据图示回答下列问题: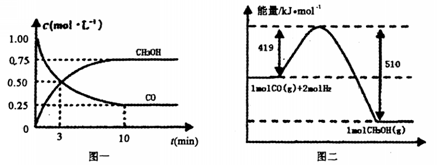
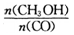 增大的有________________
增大的有________________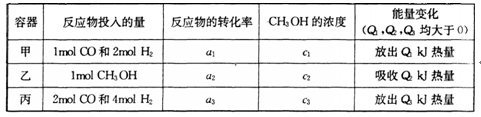
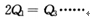
 2NH3反应,在下列比例中,生成NH3的量最多的是:
2NH3反应,在下列比例中,生成NH3的量最多的是: B(g)+3C(g)达到平衡时,A、B、C的物质的量分别是6mol,2mol,6mol.在保持温度和压强不变的条件下,下列说法正确的是
B(g)+3C(g)达到平衡时,A、B、C的物质的量分别是6mol,2mol,6mol.在保持温度和压强不变的条件下,下列说法正确的是 CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题: 或"不能确定")
或"不能确定") (g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示: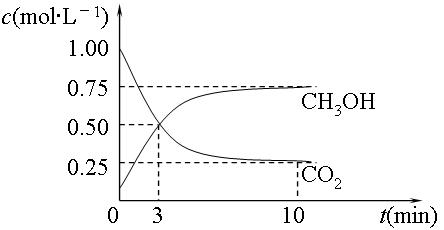
 据如下。下列说法正确的是
据如下。下列说法正确的是  N2O4(气) ΔH<0, 达到平衡后, 若分别改变下列条件, 重新达到平衡状态后, 能够使混合气体的平均相对分子质量减小的是:( )
N2O4(气) ΔH<0, 达到平衡后, 若分别改变下列条件, 重新达到平衡状态后, 能够使混合气体的平均相对分子质量减小的是:( )