题目内容
【题目】(1)1.5 mol氧气中含有的O2的个数为_____________,标准状况下体积为_________L,与_____________gH2O所含的原子总数相等。
(2)在标准状况下,体积为6.72L的NO和NO2混合气,质量为11.88g,则NO和NO2的体积比为___________。
(3)同温同压下,两种气体A和B的体积之比为2∶1,质量之比为8∶5,则A与B的密度之比为________,摩尔质量之比为_______。
(4)某状况下,2g二氧化碳气体的体积是1120 mL,2gA气体的体积是770 mL,A的摩尔质量是______________。
(5)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是________。
【答案】9.03×1023 33.6 18 2:3 4:5 4:5 64g/mol 0.025mol
【解析】
(1)1.5 mol氧气中含有的O2个数为1.5mol×6.02×1023/mol=9.03×1023,标准状况下体积为1.5mol×22.4L/mol=33.6L。含有氧原子的物质的量是3mol,则与1molH2O所含的原子总数相等,质量是18g。
(2)在标准状况下,体积为6.72L的NO和NO2混合气,质量为11.88g,混合气体的物质的量是6.72L÷22.4L/mol=0.3mol,则混合气体的平均相对分子质量是11.88÷0.3=39.6,所以根据十字交叉法可知NO和NO2的体积比为![]() 。
。
(3)同温同压下,两种气体A和B的体积之比为2∶1,质量之比为8∶5,则根据![]() 可知A与B的密度之比为
可知A与B的密度之比为![]() 。根据阿伏加德罗定律可知相同条件下气体的摩尔质量之比等于密度之比,即为4:5。
。根据阿伏加德罗定律可知相同条件下气体的摩尔质量之比等于密度之比,即为4:5。
(4)某状况下,2g二氧化碳气体的体积是1120 mL,2gA气体的体积是770 mL,则根据阿伏加德罗定律可知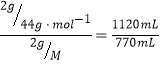 ,解得M=64g/mol,即A的摩尔质量是64g/mol。
,解得M=64g/mol,即A的摩尔质量是64g/mol。
(5)某硫酸钠溶液中含有3.01×1022个Na+,物质的量是0.05mol,则根据硫酸钠的化学式Na2SO4可知溶液中SO42-的物质的量是0.05mol÷2=0.025mol。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案


