题目内容
【题目】细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌治铜的生产流程为:
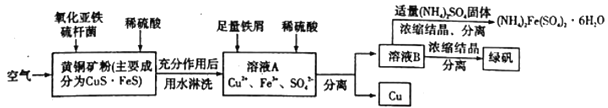
(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是______________________________。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须_______________________。在溶液B中加入适量(NH4)2 (SO4)2固体,加热浓缩时,可以得 到(NH4)2Fe(SO4)4·6H2O的原因是________________________________________________。
(3)溶液B中一定含有的阳离子是________________。若在溶液A中加入少量铁屑只发生其中的一个反应,则此反应的平衡常数的表达式为_______________________________。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成溶液A的离子方程式:___________________________________。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,可用作陶瓷和搪瓷的着色剂和红色 玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据2Cu+H2O![]() Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
【答案】 胶体的分散质(或胶体粒子)能通过滤纸孔隙 密封保存,防止被空气中氧气氧化 相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小 Fe2+(或多写H+) 表达式为:K=c3(Fe2+) /c2(Fe3+) 4CuS·FeS+17O2+4H+![]() 4Cu2++4Fe3++8SO42-+2H2O
4Cu2++4Fe3++8SO42-+2H2O  (电极与电源电极不得接错,阴极材料必须合理)
(电极与电源电极不得接错,阴极材料必须合理)
【解析】试题分析:(1)上述生产流程中有三步用到了同一种分离方法是过滤,胶体粒子能通过滤纸;(2)绿矾是一种良好的还原剂,易被氧化;相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小;(3)溶液A中的Fe3+、Cu2+都能与铁屑反应生成Fe2+;氧化性Fe3+>Cu2+,加入少量铁屑只发生![]() 反应;(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-;(5)根据2Cu+H2O
反应;(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-;(5)根据2Cu+H2O![]() Cu2O+H2↑反应,铜失电子发生氧化反应,所以要用铜作阳极;
Cu2O+H2↑反应,铜失电子发生氧化反应,所以要用铜作阳极;
解析:(1)上述生产流程中有三步用到了同一种分离方法是过滤,胶体粒子能通过滤纸,所以不能用过滤法来分离液态胶体中分散质;(2)绿矾是一种良好的还原剂,易被氧化,所以保存绿矾时,必须密封保存,防止被空气中氧气氧化;相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小,所以在溶液B中加入适量(NH4)2 SO4固体,加热浓缩时,可以得到(NH4)2Fe(SO4)2·6H2O;(3)溶液A中的Fe3+、Cu2+都能与铁屑反应生成Fe2+,所以加入足量铁粉后溶液中一定有Fe2+;氧化性Fe3+>Cu2+,加入少量铁屑只发生![]() 反应,平衡常数的表达式为:K=c3(Fe2+) /c2(Fe3+);(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-,反应离子方程式是4CuS·FeS+17O2+4H+
反应,平衡常数的表达式为:K=c3(Fe2+) /c2(Fe3+);(4)CuS·FeS在氧化亚铁硫杆菌作用下被空气氧化生成Fe3+、Cu2+、SO42-,反应离子方程式是4CuS·FeS+17O2+4H+![]() 4Cu2++4Fe3++8SO42-+2H2O;(5)根据2Cu+H2O
4Cu2++4Fe3++8SO42-+2H2O;(5)根据2Cu+H2O![]() Cu2O+H2↑反应,铜失电子发生氧化反应,可用电解法制备氧化亚铜,用铜作阳极,工业生产氧化亚铜的装置图是
Cu2O+H2↑反应,铜失电子发生氧化反应,可用电解法制备氧化亚铜,用铜作阳极,工业生产氧化亚铜的装置图是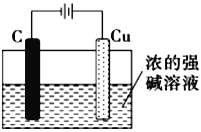 ;
;