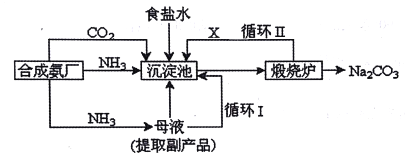
��Ŀ����
����Ŀ����1����֪����2Fe��s��+O2��g��=2 FeO��s����H1=��544.0kJmol��1��
��4Al��s��+3O2��g���T2Al2O3��s����H2=��3351.4kJmol��1��
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��
��2����Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B����ͼ��ʾ��
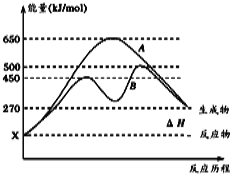
�پ�ͼ�жϸ÷�Ӧ�� ��������š����ȷ�Ӧ������Ӧ�ﵽƽ��������������䣬�����¶ȣ��淴Ӧ���ʽ� �����������С�����䡱����
������B���̱����˷�Ӧ���õ�����Ϊ ������ĸ����
A�������¶� B������Ӧ���Ũ��
C�������¶� D��ʹ�ô���
��3����֪�Ȼ�ѧ����ʽ��2H2��g��+O2��g��=2H2O��g����H=��483.6kJmol��1���÷�Ӧ�Ļ��Ϊ334.4kJmol��1�������淴Ӧ�Ļ��Ϊ ��
���𰸡���1��2Al��s��+3FeO��s���TAl2O3��s��+3Fe��s����H=��859.7 kJmol��1
��2����������������D����3��818.0 kJmol��1
��������
�����������1����֪����2Fe��s��+O2��g��=2 FeO��s����H1=��544.0kJmol��1����4Al��s��+3O2��g���T2Al2O3��s����H2=��3351.4kJmol��1�����ݸ�˹���ɣ�����-����3����2��2Al��s��+3FeO��s���TAl2O3��s��+3Fe��s����H=��859.7 kJmol��1��
��2���پ�ͼ�ж���Ӧ����е�������������������ͣ��÷�Ӧ�����ȷ�Ӧ������Ӧ�ﵽƽ��������������䣬�����¶ȣ������淴Ӧ���ʽ�������������B���������˷�Ӧ�Ļ�ܣ��˷�Ӧ���õ�����Ϊʹ�ô�����ѡD��
��3����ѧ��Ӧ���ʱ��������Ӧ�Ļ�ܼ�ȥ�淴Ӧ�Ļ�ܡ����淴Ӧ�Ļ��Ϊx������483.6kJmol��1=334.4kJmol��1-x�����x=818.0 kJmol��1��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij��ѧ��ȤС��Ϊ��̽��̼�����ϡ���ᷴӦ�����е����ʱ仯����VmLϡ�����м���������̼��ƣ��ռ���Ӧ�ų���CO2����������ѻ���Ϊ��״���µ���ֵ����ʵ���¼���£��ۼ�ֵ����
ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
CO2�����mL�� | 50 | 120 | 232 | 290 | 310 |
��1��0��1 min��1��2 min��2��3 min��3��4 min��4��5 min���ʱ����У�_________��Ӧ������졣
��2��������Һ������䣬4��5minʱ����������Ũ�ȱ仯����ʾ�ĸ÷�Ӧ����Ϊ____________________________��
��3��Ϊ�˽���������ѧ��Ӧ�ķ�Ӧ���ʣ�����Һ�м����������ʣ�����Ϊ���е���
_______________�����ţ���
a������ˮ b��Ũ���� c��NaCl���� d��NaCl��Һ
��4���������������⣬����Ϊ�����Բ�ȡ��Щ��ʩ�����ͻ�ѧ��Ӧ���ʣ�����д������_______________________________________________________________________��
________________________________________________________________________��