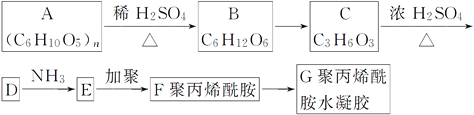
题目内容
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ______。
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)═NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)═2H2O(1)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 ______。
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
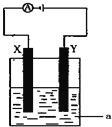
①若a为CuSO4溶液,则电解时的化学反应方程式为 ______ .通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 ______。
【答案】 C H2+2OH--2e-=2H2O 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4 0.4mol
2Cu+O2↑+2H2SO4 0.4mol
【解析】(1)能设计成原电池的反应通常是放热反应,同时也必须是氧化还原反应。氢气和氧气反应生成水的反应是一个放热的氧化还原反应,所以在理论上可以设计成原电池,选C。
(2)以KOH溶液为电解质溶液,可以设计一个氢氧燃料电池,其负极上氢气发生氧化反应,电极反应式为 H2+2OH--2e-=2H2O 。
(3)①若a为CuSO4溶液,则电解时,阳极上发生2 H2O-4e-=O2↑+4H+,阴极上发生Cu2++2 e-=Cu,总反应的化学反应方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4.由电极反应式可知,n(e-)=n(H+),通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH。因为0.2molCuO可以与0.4mol H+反应,所以电解过程中转移的电子的物质的量为0.4mol 。
2Cu+O2↑+2H2SO4.由电极反应式可知,n(e-)=n(H+),通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH。因为0.2molCuO可以与0.4mol H+反应,所以电解过程中转移的电子的物质的量为0.4mol 。

【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变