题目内容
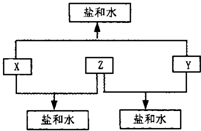
已知:①A、B、C、D四种物质均含有元素X,有的还有可能含有元素Y、Z.且元素Y、X、Z的原子序数依次递增.②X在A、B、C、D四种物质中都不呈现其最高化合价.③室温下单质A与某种常见一元强碱溶液反应,可得到B和C.④化合物D受热分解,可制得元素Y的单质.试根据以上叙述回答:
(1)写出A、B、C、D的化学式::A
(2)写出③、④中的两个化学方程式③
(1)写出A、B、C、D的化学式::A
Cl2
Cl2
BKCl(或KClO)
KCl(或KClO)
CKClO(KCl)
KClO(KCl)
DKClO3
KClO3
.(2)写出③、④中的两个化学方程式③
Cl2+2KOH=KCl+KClO+H2O
Cl2+2KOH=KCl+KClO+H2O
④2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
.
| ||
| △ |
分析:室温下单质A与某种常见一元强碱溶液反应,可得到B和C,且A、B、C中都含有X,说明A中元素在碱中发生了歧化反应,常温下能与碱溶液发生歧化反应的在中学化学中主要是Cl2、Br2等,化合物D受热催化分解生成B,可制得元素Y的单质,可知应为KClO3分解,由此可知X为氯元素,Y为氧元素,Z为K元素,A为Cl2,D为KClO3,B为KCl,C为KClO.
解答:解:室温下单质A与某种常见一元强碱溶液反应,可得到B和C,且A、B、C中都含有X,说明A中元素在碱中发生了歧化反应,常温下能与碱溶液发生歧化反应的在中学化学中主要是Cl2、Br2等,化合物D受热分解生成B,可得元素Y的单质,可知应为KClO3分解,由此可知X为氯元素,Y为氧元素,Z为K元素,A为Cl2,D为KClO3,B为KCl(或KClO),C为KClO(KCl).
(1)由上述分析可知,A为Cl2,B为KCl(或KClO),C为KClO(KCl),D为KClO3.
故答案为:Cl2;KCl(或KClO);KClO(KCl);KClO3.
(2)③中氯气与氢氧化钾反应,生成氯化钾、次氯酸钾和水,反应方程式为Cl2+2KOH=KCl+KClO+H2O.
④中氯酸钾分解生成氯化钾和氧气,反应方程式为2KClO3
2KCl+3O2↑.
故答案为:2KClO3
2KCl+3O2↑.
(1)由上述分析可知,A为Cl2,B为KCl(或KClO),C为KClO(KCl),D为KClO3.
故答案为:Cl2;KCl(或KClO);KClO(KCl);KClO3.
(2)③中氯气与氢氧化钾反应,生成氯化钾、次氯酸钾和水,反应方程式为Cl2+2KOH=KCl+KClO+H2O.
④中氯酸钾分解生成氯化钾和氧气,反应方程式为2KClO3
| ||
| △ |
故答案为:2KClO3
| ||
| △ |
点评:考查学生对元素化合物知识的熟悉程度,学生综合题中信息,结合对物质性质的了解,猜测出一些物质C12、KC1O3等,再顺推、逆推和逐个验证,便可确定出全部答案,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1
已知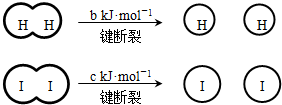 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
已知
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
| A、反应物的总能量高于生成物的总能量 | B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 | C、断开2mol H-I键所需能量约为(c+b+a)kJ | D、向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ |

 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
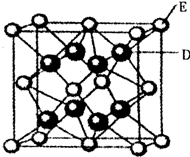 已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.