题目内容
 已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和.请回答下列问题:
(1)分子式为BC2的空间构型为
直线型
直线型
;F2+的核外电子排布式为1s22s22p63s23p63d9
1s22s22p63s23p63d9
.(2)A分别与B、C形成的最简单化合物的稳定性B
小于
小于
C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为
sp3
sp3
.(3)A2C所形成的晶体类型为
分子晶体
分子晶体
;F单质形成的晶体类型为金属晶体
金属晶体
,其采用的堆积方式为面心立方最密堆积
面心立方最密堆积
.(4)F元素氧化物的熔点比其硫化物的
高
高
(填“高”或“低”),请解释其原因CuO的晶格能大于CuS的晶格能
CuO的晶格能大于CuS的晶格能
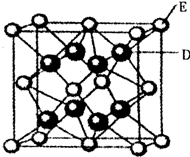
.(5)D跟E可形成离子化合物其晶胞结构如图.该离子化合物晶体的密度为ρg?cm-3.则晶胞的体积是
| 5.2×10-22 |
| ρ |
| 5.2×10-22 |
| ρ |
分析:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,则A为H元素;B元素基态原子的2P轨道上只有两个电子,B原子核外电子排布式为1s22s22p2,则B为C元素;C元素的基态原子L层只有2对成对电子,则C原子核外电子排布式为1s22s22p4,则B为O元素;D是元素周期表中电负性最大的元素,则D为F元素;E2+的核外电子排布和Ar原子相同,则E原子核外电子数为18+2=20,则E为Ca;F的核电荷数是D和E的核电荷数之和,则F的核电荷数为9+20=29,则F为Cu,据此解答.
解答:解:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,则A为H元素;B元素基态原子的2P轨道上只有两个电子,B原子核外电子排布式为1s22s22p2,则B为C元素;C元素的基态原子L层只有2对成对电子,则C原子核外电子排布式为1s22s22p4,则C为O元素;D是元素周期表中电负性最大的元素,则D为F元素;E2+的核外电子排布和Ar原子相同,则E原子核外电子数为18+2=20,则E为Ca;F的核电荷数是D和E的核电荷数之和,则F的核电荷数为9+20=29,则F为Cu,
(1)CO2的空间构型为直线型;Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:直线型;1s22s22p63s23p63d9;
(2)A分别与B、C形成的最简单化合物为CH4、H2O,非金属性C<O,故稳定性CH4<H2O;A、C两元素可组成原子个数比为1:1的化合物为H2O2,O原子成2个σ键、含有2对孤对电子,杂化轨道数为4,采取sp3杂化,
故答案为:小于;sp3;
(3)H2O所形成的晶体类型为分子晶体;Cu单质形成的晶体类型为金属晶体,其采用的堆积方式为面心立方最密堆积,
故答案为:分子晶体;金属晶体;面心立方最密堆积;
(4)氧离子半径小于硫离子半径,CuO的晶格能大于CuS的晶格能,故CuO晶体的沸点较高,
故答案为:高;CuO的晶格能大于CuS的晶格能;
(5)晶胞中氟离子数目=8、钙离子数目=8×
+6×
=4,故晶胞质量=
g,离子化合物晶体的密度为ρg?cm-3.则晶胞的体积=
=
cm-3,
故答案为:
cm-3.
(1)CO2的空间构型为直线型;Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:直线型;1s22s22p63s23p63d9;
(2)A分别与B、C形成的最简单化合物为CH4、H2O,非金属性C<O,故稳定性CH4<H2O;A、C两元素可组成原子个数比为1:1的化合物为H2O2,O原子成2个σ键、含有2对孤对电子,杂化轨道数为4,采取sp3杂化,
故答案为:小于;sp3;
(3)H2O所形成的晶体类型为分子晶体;Cu单质形成的晶体类型为金属晶体,其采用的堆积方式为面心立方最密堆积,
故答案为:分子晶体;金属晶体;面心立方最密堆积;
(4)氧离子半径小于硫离子半径,CuO的晶格能大于CuS的晶格能,故CuO晶体的沸点较高,
故答案为:高;CuO的晶格能大于CuS的晶格能;
(5)晶胞中氟离子数目=8、钙离子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 4×78 |
| 6.02×1023 |
| ||
| ρ g/cm3 |
| 5.2×10-22 |
| ρ |
故答案为:
| 5.2×10-22 |
| ρ |
点评:本题考查物质结构与性质,涉及核外电子排布规律、杂化理论、分子结构、晶体类型与性质、晶胞计算等,推断元素是解题的关键,(5)中注意利用均摊法进行晶胞计算.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质
 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
 已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.
已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.