题目内容
已知:A、B、C、D、E、F、G七种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,原子序数依次增大,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,A与F、E与F组成的化合物是机动车排出的大气污染物,G是原子半径最小的元素.试推断回答下列问题: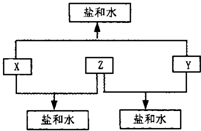
(1)D元素周期表中的位置为 A、B、C三种元素的离子半径由小到大的顺序为 (用元素符号表示).由以上元素中两两形成的化合物中,含有离子键和非极性共价键的化合物的电子式为 .
(2)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式 ; A的气态氢化物2.24L(标准状况)被 200mL 1moL/L X溶液吸收后,所得溶液中离子浓度从大到小的顺序是 .
(3)一定温度下,向2L密闭容器中充入2molA2和4molG2,若保持体积不变,0.5min后达到平衡,测得容器中有1mol AGn,则平均反应速率v(A2)= .若保持温度和体积不变,向平衡体系中加入 1mol G2和1molAGn,则平衡的移动方向 (填“正反应方向”、“逆反应方向”或“不移动”﹚.

(1)D元素周期表中的位置为
(2)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式
(3)一定温度下,向2L密闭容器中充入2molA2和4molG2,若保持体积不变,0.5min后达到平衡,测得容器中有1mol AGn,则平均反应速率v(A2)=
分析:A、B、C、D、E、F、G七种短周期元素,D元素组成的单质在通常状况下呈黄绿色,所以D是Cl元素;G是原子半径最小的元素,则G为H元素;A与F、E与F组成的化合物是机动车排出的大气污染物,为CO及氮的氧化物,可推知F为O元素,A、E分别是碳、氮元素中的一种,B、C、D三种元素位于同一周期,处于第三周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,由框图转化关系可知,三物质之间两两反应都生成盐与水,应是氢氧化铝、强碱、强酸的反应,可推知A为N元素,E为碳元素,则B、C中一定含有Al元素;N与Cl的原子序数之和等于B与C的原子序数之和,B、C中另外元素原子序数=7+17-13=11,为Na元素,B、C、D三种元素原子序数依次增大,则B为Na,C为Al,可推知X为硝酸、Y为NaOH、Z为Al(OH)3,据此解答.
解答:解:A、B、C、D、E、F、G七种短周期元素,D元素组成的单质在通常状况下呈黄绿色,所以D是Cl元素;G是原子半径最小的元素,则G为H元素;A与F、E与F组成的化合物是机动车排出的大气污染物,为CO及氮的氧化物,可推知F为O元素,A、E分别是碳、氮元素中的一种,B、C、D三种元素位于同一周期,处于第三周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,由框图转化关系可知,三物质之间两两反应都生成盐与水,应是氢氧化铝、强碱、强酸的反应,可推知A为N元素,E为碳元素,则B、C中一定含有Al元素;N与Cl的原子序数之和等于B与C的原子序数之和,B、C中另外元素原子序数=7+17-13=11,为Na元素,B、C、D三种元素原子序数依次增大,则B为Na,C为Al,可推知X为硝酸、Y为NaOH、Z为Al(OH)3,
(1)D为Cl元素,周期表中的位置为第三周期第ⅦA族,N3-、Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径由小到大的顺序为N3->Na+>Al3+.由以上元素中两两形成的化合物中,含有离子键和非极性共价键的化合物为Na2O2,其电子式为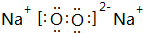 ,
,
故答案为:第三周期第ⅦA族;N3->Na+>Al3+; ;
;
(2)NaOH与氧化铝反应生成偏铝酸钠与水,该反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
A的气态氢化物为NH3,2.24L(标准状况)氨气的物质的量=
=0.1mol,200mL 1moL/L硝酸溶液中n(HNO3)=0.2L×1mol/L=0.2mol,二者按1:1反应,用硝酸吸收氨气后为NH4NO3、HNO3按1:1混合溶液,溶液呈酸性,且NH4+水解,故溶液中离子浓度大小关系为c(NO3-)>c(H+)>c(NH4+)>c(OH-),
故答案为:Al2O3+2OH-=2AlO2-+H2O;c(NO3-)>c(H+)>c(NH4+)>c(OH-);
(3)一定温度下,向2L密闭容器中充入2molN2和4molH2,若保持体积不变,0.5min后达到平衡,测得容器中有1mol NH3,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):2 4 0
变化(mol):0.5 1.5 1
平衡(mol):1.5 2.5 1
故平均反应速率v(N2)=
=0.5mol/(L.min),
该温度下平衡常数k=
=0.17
若保持温度和体积不变,向平衡体系中加入 1mol N2和1molNH3,则此时Qc=
=0.41>k=0.17,故则平衡的移动方向逆反应方向,
故答案为:0.5mol/(L.min);逆反应方向.
(1)D为Cl元素,周期表中的位置为第三周期第ⅦA族,N3-、Na+、Al3+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径由小到大的顺序为N3->Na+>Al3+.由以上元素中两两形成的化合物中,含有离子键和非极性共价键的化合物为Na2O2,其电子式为
 ,
,故答案为:第三周期第ⅦA族;N3->Na+>Al3+;
 ;
;(2)NaOH与氧化铝反应生成偏铝酸钠与水,该反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
A的气态氢化物为NH3,2.24L(标准状况)氨气的物质的量=
| 2.24L |
| 22.4L/mol |
故答案为:Al2O3+2OH-=2AlO2-+H2O;c(NO3-)>c(H+)>c(NH4+)>c(OH-);
(3)一定温度下,向2L密闭容器中充入2molN2和4molH2,若保持体积不变,0.5min后达到平衡,测得容器中有1mol NH3,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):2 4 0
变化(mol):0.5 1.5 1
平衡(mol):1.5 2.5 1
故平均反应速率v(N2)=
| ||
| 0.5min |
该温度下平衡常数k=
(
| ||||
|
若保持温度和体积不变,向平衡体系中加入 1mol N2和1molNH3,则此时Qc=
(
| ||||
|
故答案为:0.5mol/(L.min);逆反应方向.
点评:本题考查结构性质位置关系应用、半径比较、电子式、离子浓度大小比较、化学反应速率计算、平衡常数的应用等,难度中等,(3)中注意根据浓度商与平衡常数的相对大小判断平衡移动方向,掌握平衡常数的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质
 已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大.A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
 已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.
已知单质A、B、C、D有如下的反应关系.其中A 在B中燃烧时,火焰呈苍白色; C在B中燃烧时生成棕黄色的烟,E的水溶液呈蓝绿色,G是一种黑色固体.