题目内容
H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1
已知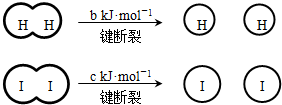 (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
已知
 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
| A、反应物的总能量高于生成物的总能量 | B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 | C、断开2mol H-I键所需能量约为(c+b+a)kJ | D、向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ |
分析:A、依据反应是放热反应,结合能量守恒分析;
B、断裂化学键吸收能量,形成化学键放出能量,结合反应是放热反应分析判断;
C、依据焓变=反应物断裂化学键需要的能量-生成物形成化学键放出的能量分析判断;
D、反应是可逆反应不能进行彻底;
B、断裂化学键吸收能量,形成化学键放出能量,结合反应是放热反应分析判断;
C、依据焓变=反应物断裂化学键需要的能量-生成物形成化学键放出的能量分析判断;
D、反应是可逆反应不能进行彻底;
解答:解:A、H2和I2在一定条件下能发生反应:H2(g)+I2(g)?2HI(g)△H=-a kJ?mol-1 ,反应是放热反应,反应物能量高于生成物,故A正确;
B、断裂化学键吸收能量,形成化学键放出能量,反应是放热反应所以形成化学键放出的能量大于断裂化学键吸收的能量,断开1mol H-H键和1mol I-I键所需能量小于断开2mol H-I键所需能量,故B错误;
C、△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bKJ/mol+cKJ/mol-2H-I=-aKJ/mol,得到断开2mol H-I键所需能量约为(a+b+c)KJ,故C正确;
D、反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D正确;
故选B.
B、断裂化学键吸收能量,形成化学键放出能量,反应是放热反应所以形成化学键放出的能量大于断裂化学键吸收的能量,断开1mol H-H键和1mol I-I键所需能量小于断开2mol H-I键所需能量,故B错误;
C、△H=反应物断裂化学键需要的能量-生成物形成化学键放出的能量=bKJ/mol+cKJ/mol-2H-I=-aKJ/mol,得到断开2mol H-I键所需能量约为(a+b+c)KJ,故C正确;
D、反应是可逆反应不能进行彻底,依据焓变意义分析,向密闭容器中加入2mol H2和2mol I2,充分反应后放出的热量小于2a kJ,故D正确;
故选B.
点评:本题考查了化学反应的焓变分析,化学键与焓变关系的计算分析应用,掌握原理和基础是解题关键,题目难度中等.

练习册系列答案
相关题目
 由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.
由短周期元素组成的10种物质A~J之间有下图关系.已知:A、B为同周期相邻元素的单质,其余均为化合物;通常情况下A为固体,B、D为气体且B呈黄绿色,F为液体,A和G的浓溶液加热时反应生成D和F,J在光照时有I生成.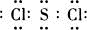
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 2HI(g)
△H=—a kJ·mol-1
2HI(g)
△H=—a kJ·mol-1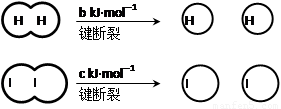 (a、b、c均大于零)
(a、b、c均大于零)