题目内容
【题目】(1)反应3A(g)+B(g) ===2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是 。(用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
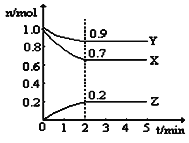
①该反应的化学方程式为____________________________。
②反应开始至2min,以气体Z表示的平均反应速率为 。
③2min反应达平衡容器内混合气体的平均相对分子质量比起 始时 (填“大”,“小”或“相等”下同),混合气体密度比起始时 。
④上述反应,在第2min时,X的转化率为 。
⑤将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X) = n (Y) = n (Z),则原混合气体中a : b =__________。
【答案】(1)③>①>②(2)①3X+Y![]() 2Z ② 0.02 mol·L-1·min-1 ③大;相等④30% ⑤5:3
2Z ② 0.02 mol·L-1·min-1 ③大;相等④30% ⑤5:3
【解析】
试题分析:(1)比较反应速率时,应用同种物质表示不同条件下的反应速率,再进行比较,比如,可以用反应物B表示反应速率:①vB=![]() mol/(L·min)、②vB=0.25 mol/(L·min)、③vB=0.5 mol/(L·min),因此反应速率由大到小的关系为:③>①>②;
mol/(L·min)、②vB=0.25 mol/(L·min)、③vB=0.5 mol/(L·min),因此反应速率由大到小的关系为:③>①>②;
(2)①化学计量数之比等于各物质的转化量之比,即化学计量数之比为:0.3: 0.1:0.2=3: 1:2,即化学方程式为:3X+Y![]() 2Z;②反应开始至2min,气体Z生成0.2mol,用Z表示的平均反应速率为:
2Z;②反应开始至2min,气体Z生成0.2mol,用Z表示的平均反应速率为: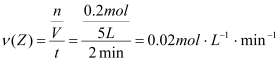 ;③2min反应达平衡容器内混合气体的平均相对分子质量比起开始时大,由于混合气体的质量自始至终不变,而在固体容积中发生反应,因此混合气体的密度比起始时不变;④在第2min时,X的转化率为:
;③2min反应达平衡容器内混合气体的平均相对分子质量比起开始时大,由于混合气体的质量自始至终不变,而在固体容积中发生反应,因此混合气体的密度比起始时不变;④在第2min时,X的转化率为:![]() ;
;
⑤设Y的变化量为x,则:
3X+Y![]() 2Z
2Z
起始(mol) a b 0
转化(mol) 3x x 2x
某时刻(mol) a-3x b-x 2x
由于n (X) = n (Y) = n (Z),则a-3x= b-x=2x,则a=5x,b=3x,故a:b=5:3。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】除去下列物质中的杂质(括号中为杂质),采用的试剂和除杂方法错误的是( )
序号 | 待除杂质 | 试剂 | 除杂方法 |
A | C2H4(SO2) | NaOH溶液 | 洗气 |
B | C6H6(Br2) | Fe粉 | 蒸馏 |
C | C6H5NO2(NO2) | NaOH | 分液 |
D | C2H2(H2S) | CuSO4 | 洗气 |
A. A B. B C. C D. D