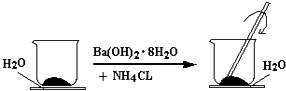
��Ŀ����
����Ŀ����A��B��C��D����Ԫ�أ���֪AԪ��ԭ�ӵĵ�һ��͵������������ͬ��BԪ��ԭ�ӵĵڶ���ȵ�һ���������5����CԪ�ص�+3�������Ӻ���ԭ�Ӿ�����ͬ�ĵ�������DԪ�ص�ԭ�Ӻ�����4�����Ӳ㣬��һ����ڶ��������֮�͵��ڵ���������IJ������֮�ͣ�д����
��1��Ԫ�ط��ţ�A �� B �� C �� D ��
��2��A��D��ԭ�ӽṹʾ��ͼ�� �� C�����ӽṹʾ��ͼ
��3��������AB2�ĵ���ʽ��ѧ������Ϊ ��
���𰸡�
��1��Mg��F��Al��Ca
��2�� ��
�� ��
��
��3��![]() �����Ӽ�
�����Ӽ�
���������⣺��1��A��B��C��D����Ԫ�أ�AԪ��ԭ�ӵĵ�һ��͵������������ͬ�������������Ϊ2����AΪMg��BԪ��ԭ�ӵĵڶ���ȵ�һ���������5�����ڶ��������Ϊ7����BΪFԪ�أ�CԪ�ص�+3�������Ӻ���ԭ�Ӿ�����ͬ�ĵ���������CΪAl��DԪ�ص�ԭ�Ӻ�����4�����Ӳ㣬��һ����ڶ��������֮�͵��ڵ���������IJ������֮�ͣ�������㡢���IJ������֮��Ϊ10��˵��ԭ�Ӻ������������ֱ�Ϊ2��8��8��2����DΪCaԪ�أ� ���Դ��ǣ�Mg��F��Al��Ca����2��AΪMg��ԭ�ӽṹʾ��ͼΪ  ��DΪCa��ԭ�ӽṹʾ��ͼΪ
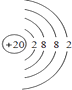
��DΪCa��ԭ�ӽṹʾ��ͼΪ  ��C������ΪAl3+ �� ���ӽṹʾ��ͼΪ
��C������ΪAl3+ �� ���ӽṹʾ��ͼΪ  ��
��
���Դ��ǣ�  ��
��  ��
��  ����3��A��B���γɵĻ�����ΪMgF2 �� ����ʽΪ
����3��A��B���γɵĻ�����ΪMgF2 �� ����ʽΪ ![]() ���������Ӽ������Դ��ǣ�
���������Ӽ������Դ��ǣ� ![]() �����Ӽ���
�����Ӽ���

 �·Ƿ��̸����100��ϵ�д�
�·Ƿ��̸����100��ϵ�д�