��Ŀ����
����Ŀ����ش��������⣺
��1����ͼ��ʾ����һ��С�ձ��������ϸ��20g Ba��OH��28H2O���壮����С�ձ��������ȵ���3��4��ˮ�IJ���Ƭ�ϣ�Ȼ����С�ձ��м���10g NH4Cl���壬���ò��������ٽ��裮 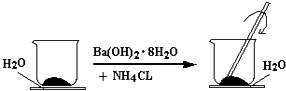
��ʵ���в�������������
��д���йط�Ӧ�Ļ�ѧ����ʽ����
���Ĵ������Ӧ���ͷ������÷�Ӧ��������
��ʵ���������˵���÷�Ӧ�ķ�Ӧ���������������ڡ���С�ڡ����������������
��2��������δ�����������Դ֮һ����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ��������¼�����2H2O ![]() 2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ� �Իش��������⣺
2H2��+O2�����Ƶõ�����������ȼ�ϵ�أ� �Իش��������⣺
�ٺ�ˮ�ֽ����ɵ���������ȼ�ϵ��ʱ��ʵ����ת��Ϊ�ܣ�ˮ�ֽ�ʱ�����ѵĻ�ѧ��Ϊ�����ֽ⺣ˮ�ķ�Ӧ������Ӧ������ȡ������ȡ�����
��ij������ȼ�ϵ�����ù�������������մ�������ʣ������Ϸ����ĵ缫��Ӧ�ֱ�Ϊ��A����2H2+2O2����4e���T2H2O��B����O2+4e���T2O2�� �� ��A���ǵ�ص��������ӴӸü�������롱������������
�������Ի�ѧ��Ӧ��2Zn+O2+4H+�T2Zn2++2H2OΪ������Ƴ�һ��ԭ��أ�������������Ϊ������������Դ�����ǿ�������ѪҺ������һ��Ũ�ȵ�O2��H+��Zn2+���й�������ԭ��صĸ����Ϸ�����Ӧ�ĵ缫��ӦʽΪ ��
��3����������ȼ�չ����У��ƻ�1molH2�еĻ�ѧ�����ĵ�����ΪQ1kJ���ƻ�1molO2�еĻ�ѧ��ΪQ2kJ���γ�1molH2O�еĻ�ѧ���ͷŵ�����ΪQ3 �� ���й�ϵʽ��ȷ����
A.Q1+Q2��Q3
B.Q1+Q2��Q3
C.2Q1+Q2��2Q3
D.2Q1+Q2��2Q3 ��
���𰸡�
��1�����裬ʹ������ֽӴ���Ba��OH��2?8H2O+2NH4Cl�TBaCl2+2NH3��+10H2O�����ֽ⣻С��
��2����ѧ���磻���ۣ����ȣ�����������Zn��2e��=Zn2+
��3��D
���������⣺��1����ʵ���в������������ǽ���ʹ��Ӧ���ֽӴ�����Ӧ�����Դ��ǣ����裬ʹ������ֽӴ������Ȼ��������Σ��ܺ�ǿ�����������������ֽⷴӦ�����ɰ�����ˮ���Լ��Ȼ�������ѧ����ʽΪBa��OH��28H2O+2NH4Cl=BaCl2+2NH3��+10H2O�����Դ��ǣ�Ba��OH��28H2O+2NH4Cl=BaCl2+2NH3��+10H2O�����ֽ⣻�۲���Ƭ�Ͻ������С�ձ�ճ��һ��˵�������������Ȼ�淋ķ�Ӧ�����ȷ�Ӧ������Ӧ���������С��������������������Դ��ǣ�С�ڣ���2����ˮ���Էֽ⣬ˮ�����д��ڹ��ۼ����ڶ������ѣ�TiO2����������ʹ��ˮ�ֽ�õ����������ü����ṩ��������˵�������������������ã��÷�Ӧ���ȣ�ȼ�ϵ���ǽ���ѧ��ת��Ϊ���ܵ�װ�ã����Դ��ǣ���ѧ���磻���ۣ����ȣ����������л�ԭ�ԣ��ڸ����ϱ�������ʧȥ���ӣ����ӴӸ��������·�������������Դ��ǣ�������������ԭ��ظ���ʧȥ���ӣ����ϼ����ߣ�����������Ӧ�������ܷ�Ӧʽ2Zn+O2+4H+�T2Zn2++2H2O���õ�������ӦΪ��Zn��2e��=Zn2+ �� ���Դ��ǣ�Zn��2e��=Zn2+����3���ƻ�1molH��H���ĵ�����ΪQ1kJ����H��H����ΪQ1kJ/mol���ƻ�1molO�TO�����ĵ�����ΪQ2kJ����O�TO������ΪQ2kJ/mol���γ�1molˮ�еĻ�ѧ���ͷŵ�����ΪQ3kJ��ÿĦ��H2O�к���2molH��O����1molH��O���ͷŵ�����Ϊ ![]() Q3kJ����H��O����Ϊ
Q3kJ����H��O����Ϊ ![]() Q3kJ/mol�����ڷ�Ӧ2H2��g��+O2��g���T2H2O��l����Ӧ�ȡ�H=��Ӧ����ܼ��ܩ���������ܼ��ܣ����Է�Ӧ�ȡ�H=2Q1kJ/mol+Q2kJ/mol��4��
Q3kJ/mol�����ڷ�Ӧ2H2��g��+O2��g���T2H2O��l����Ӧ�ȡ�H=��Ӧ����ܼ��ܩ���������ܼ��ܣ����Է�Ӧ�ȡ�H=2Q1kJ/mol+Q2kJ/mol��4�� ![]() Q3kJ/mol=��2Q1+Q2��2Q3��kJ/mol������������������ȼ�գ���Ӧ�ȡ�H��0������2Q1+Q2��2Q3����0������2Q1+Q2��2Q3 �� ���Դ��ǣ�D��
Q3kJ/mol=��2Q1+Q2��2Q3��kJ/mol������������������ȼ�գ���Ӧ�ȡ�H��0������2Q1+Q2��2Q3����0������2Q1+Q2��2Q3 �� ���Դ��ǣ�D��
�����㾫����������Ҫ�����˷�Ӧ�Ⱥ��ʱ�����֪ʶ�㣬��Ҫ�����ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�Ȳ�����ȷ�����⣮