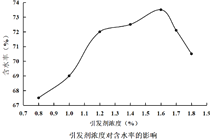
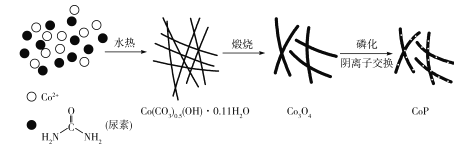
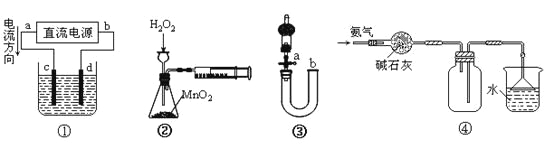
题目内容
【题目】高铁电池是电动汽车首选的电池之一,该电池的工作原理为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,
3Zn(OH)2+2Fe(OH)3+4KOH,
下列关于该电池放电时的说法中正确的是( )
A.高铁电池产生的电流从负极经外电路到达正极
B.正极反应式为Zn+2OH--2e- =Zn(OH)2
C.负极pH减小,正极pH增大,电解液pH增大
D.每氧化1mol高铁酸钾转移3mol电子
【答案】C
【解析】
A.电流的流向是正极流向负极,故A错误;
B、放电时正极K2FeO4发生得电子的还原反应,即FeO42-+3e-+4H2O=Fe(OH)3+5OH-,故B错误。
C、负极发生反应正极反应式为Zn+2OH--2e- =Zn(OH)2,消耗氢氧根,pH减小,正极生成氢氧根,pH增大,整个溶液氢氧根浓度增大,pH增大。
D、高铁酸钾中的铁化合价降低,故应是被还原故D错。
答案选C。

练习册系列答案
相关题目