题目内容
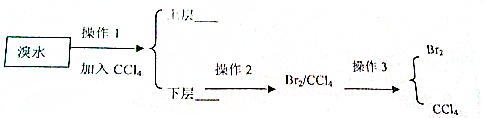
14.下列方法中不可以鉴别Fe3+和Fe2+的是( )| A. | 通过物理方法观察他们颜色的区别 | |
| B. | 向两种溶液中加入NaOH溶液 | |
| C. | 向两种溶液中加入KSCN溶液 | |
| D. | 向两种溶液中加入氯水后再加入KSCN溶液 |
分析 三价铁离子的检验方法为:取待测液于试管中,向待测溶液中加入KSCN溶液,溶液立刻变成红色说明溶液中有Fe3+,即Fe3++3SCN-?Fe(SCN)3;根据常见离子的颜色判断Fe3+(黄色);Fe3+与OH-反应生成红褐色Fe(OH)3;
二价铁离子的检验方法为:再取待测液于试管中,加KSCN溶液没有明显现象,加入氯水溶液变成红色,说明溶液只有Fe2+;根据常见离子的颜色判断Fe2+(浅绿色);向Fe2+溶液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色;据此即可解答.
解答 解:A.铁盐溶液呈黄色,亚铁溶液呈浅绿色,可以鉴别,故A正确;
B.向Fe2+溶液中加入NaOH溶液后,Fe2+与OH-反应生成Fe(OH)2,Fe2++2OH-=Fe(OH)2↓,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,4Fe(OH)2+O2+2H2O=4Fe(OH)3,白色的Fe(OH)2沉淀变成红褐色Fe(OH)3,向Fe2+溶液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色;Fe3+与OH-反应Fe3++3OH-=Fe(OH)3↓,生成红褐色Fe(OH)3,两者反应现象不同,故B正确;
C.加入KSCN溶液,发生络合反应,Fe3++3SCN-?Fe(SCN)3溶液立即呈血红色,证明含有三价铁离子;加KSCN溶液没有明显现象,说明溶液有Fe2+,故C正确;
D.加入氯水溶液,发生氧化还原反应,亚铁离子被氧化为铁离子,铁离子结合硫氰酸根离子形成血红色溶液,Fe3++3SCN-?Fe(SCN)3溶液立即呈血红色,不能证明含有二价铁离子、三价铁离子,故D错误;
故选D.
点评 本题考查了二价铁离子和三价铁离子的实验检验方法的应用,根据离子检验产生特征现象进行判断是解答的关键,题目较简单.

| A. | 7.8gNa2O2所含离子总数为0.4NA | |
| B. | 2.0gD2O(重水)含有的质子数是NA | |
| C. | 标准状况下,0.5NA个HF分子所占的体积约为11.2L | |
| D. | 4℃时,18mL水分子中所含共价键的数目为4NA |
| A. | 铊位于第五周期ⅢA族 | |
| B. | 氧化性:Tl3+>Ag+>Fe3+ | |
| C. | Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 | |
| D. | Tl+最外层有3个电子 |
| A. | 0.1mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1mol•L-1的NH4Cl和0.1mol•L-1的NH3•H2O等体积混合后溶液中离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸,则水的电离程度会减小 | |
| D. | 2L 0.5mol•L-1 CH3COOH和5L 0.2mol•L-1 CH3COOH溶液中的H+数目相等 |
| A. | FeCl3 | B. | Al2S3 | C. | CuS | D. | Fe2S3 |
 汽车尾气是造成空气污染的原因之一,汽车三元催化器中的催化剂将增强汽车尾气中 CO、C、H,和NO三种气体的活性.使它们相互反应生成无污染气体除去,
汽车尾气是造成空气污染的原因之一,汽车三元催化器中的催化剂将增强汽车尾气中 CO、C、H,和NO三种气体的活性.使它们相互反应生成无污染气体除去,