题目内容
【题目】对于反应KMn04+ HCl—KC1+ MnCl2+Cl2+ H20(未配平),若有0.1 mol KMn04参加反应,下列说法正确的是 ( )
A. 转移0.5 mol电子 B. 生成0.5 mol Cl2
C. 参加反应的HC1为1.6 mol D. Cl2是还原产物
【答案】A
【解析】
该反应中Mn元素化合价由+7价变为+2价,氯元素的化合价由-1价变为0价,根据转移电子相等、原子守恒配平方程式得2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,根据高锰酸钾和这些物理量之间的关系式计算。
根据转移电子相等、原子守恒配平方程式得2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,
A.当有0.1mol KMnO4参加反应,转移电子的物质的量=0.1mol×(7-2)=0.5mol,选项A正确;
B.根据方程式中高锰酸钾和氯气之间的关系式知,生成氯气的物质的量=![]() ×5=0.25mol,选项B错误;
×5=0.25mol,选项B错误;
C.根据高锰酸钾和被氧化的氯化氢之间的关系式知,被氧化的氯化氢的物质的量=![]() ×10=0.5mol,选项C错误;
×10=0.5mol,选项C错误;
D.该反应中氯元素失电子而作还原剂,则氯气是氧化产物,选项D错误;
答案选A。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
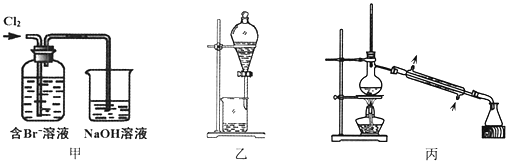
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。

①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(2)25 ℃,两种酸的电离常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HCO![]() 的电离常数表达式K=________。
的电离常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________________。