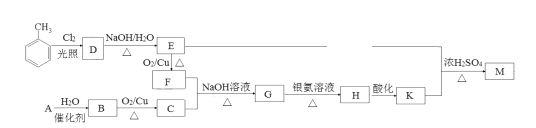
题目内容
【题目】(1)写出醋酸的电离方程式:_____________________________________;
(2)写出醋酸电离平衡常数表达式:_______________;
(3)向0.1mol/L 醋酸溶液中加入水,电离平衡向_______移动 (填“左”或“右”) ;n(CH3COOH)_______; c(CH3COO-)/c(H+)_______(填“增大”、“减小”或“不变”);
(4)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a___b;生成H2的量a____b;完全中和这两种酸,消耗NaOH的量a___b(填“<”、“>”或“=”)。
【答案】CH3COOH ![]() CH3COO-+H+
CH3COO-+H+  右 增大 减小 不变 = =
右 增大 减小 不变 = =
【解析】
(1)本题考查弱电解质的电离,醋酸属于弱酸,发生部分电离,电离方程式为CH3COOH ![]() CH3COO-+H+;(2)考查电离平衡常数,根据电离平衡常数的定义,醋酸的电离平衡常数为Ka=
CH3COO-+H+;(2)考查电离平衡常数,根据电离平衡常数的定义,醋酸的电离平衡常数为Ka= 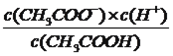 ;(3)考查影响电离平衡移动的因素,加水促进电离,电离平衡向右移动,n(CH3COOH)的减小,因为是同一溶液,c(CH3COO-)/c(H+)=n(CH3COO-)/n(H+),根据醋酸电离方程式,因此c(CH3COO-)/c(H+)不变;(4)本题考查一元强酸和一元强碱,醋酸是弱酸,盐酸是强酸,相同浓度时醋酸中c(H+)小于盐酸中c(H+),因此初始速率时a<b;锌是过量,盐酸和醋酸物质的量相同,因此产生氢气的量相同,即a=b;两种酸的物质的量相同,即消耗NaOH的量相等,即a=b。
;(3)考查影响电离平衡移动的因素,加水促进电离,电离平衡向右移动,n(CH3COOH)的减小,因为是同一溶液,c(CH3COO-)/c(H+)=n(CH3COO-)/n(H+),根据醋酸电离方程式,因此c(CH3COO-)/c(H+)不变;(4)本题考查一元强酸和一元强碱,醋酸是弱酸,盐酸是强酸,相同浓度时醋酸中c(H+)小于盐酸中c(H+),因此初始速率时a<b;锌是过量,盐酸和醋酸物质的量相同,因此产生氢气的量相同,即a=b;两种酸的物质的量相同,即消耗NaOH的量相等,即a=b。

 阅读快车系列答案
阅读快车系列答案【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:

焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。