题目内容
1.请按要求回答下列问题.(1)根据图1回答①②:
①A电极可观察到的现象是锌极镀上一层红色物质,电极反应式为Cu2++2e-═Cu;B极的电极反应式为Cu-2e-═Cu2+.
②通电一段时间后,CuSO4溶液的浓度不变,pH不变(填“变大”、“变小”或“不变”).
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为4OH--4e-═2H2O+O2↑,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+.
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积0.175aL.

分析 (1)①为电解池,Cu为阳极不断溶解,Zn为阴极,铜离子在阴极放电生成Cu;
②该池为电镀池,电解质溶液浓度不变,pH不变;
(2)电镀时,石墨为阳极,发生氧化反应,生成氧气,铜为阴极,发生还原反应,以此解答.
解答 解:(1)①为电解池,Cu为阳极不断溶解,电极反应式为:Cu-2e-═Cu2+,Zn为阴极,铜离子在阴极放电生成Cu,锌极镀上一层红色的铜,电极方程式为Cu2++2e-═Cu,
故答案为:锌极镀上一层红色物质;Cu2++2e-═Cu;
②该池为电镀池,电解质溶液浓度不变,pH不变,故答案为:不变;不变;
(2)③电镀时,石墨为阳极,发生氧化反应,电极方程式为4OH--4e-═2H2O+O2↑,生成氧气,铜为阴极,总反应式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+,
故答案为:4OH--4e-═2H2O+O2↑;2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;
④铜电极增重a g,n(Cu)=$\frac{a}{64}$mol,转移$\frac{a}{32}$mol电子,由可知4OH--4e-═2H2O+O2↑,生成n(O2)=$\frac{1}{4}$×$\frac{a}{32}$mol,
则体积为$\frac{1}{4}$×$\frac{a}{32}$mol×22.4L/mol=0.175aL,
故答案为:0.175a.
点评 本题综合考查原电池和电解池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握原电池、电解池的工作原理以及电极方程式的书写,难度中等.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
12.下列与硫酸型酸雨的形成无关的是( )
| A. | 工业上大量含硫燃料的燃烧 | B. | 工业生产使空气中CO2含量增加 | ||
| C. | SO2在尘埃催化下氧化为SO3 | D. | SO3与水反应生成H2SO4 |
6.常温时的下列溶液,说法正确的是( )
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | CH3COONa溶液与HCl溶液混合所得的中性溶液中:c(Na+)>c(Cl-) | |
| C. | Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| D. | pH=8的NaHCO3溶液中:c(HCO3-)>c(CO32-)>c(OH-) |
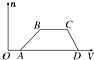 某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示.回答下列问题.
 、
、 ;
;