题目内容
[2012·江门调研]下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.含20.0g的NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4 kJ·mol-1

D.已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ/mol
则Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1
A.甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1
B.含20.0g的NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4 kJ·mol-1

D.已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6kJ/mol
则Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1
D
燃烧热是指1mol物质完全燃烧生成稳定的氧化物时放出的热量,A项中H2O应为液态,A项错;B项忽视了醋酸电离需要吸收热量;ΔH=吸收的能量-释放的能量=419kJ·mol-1-510kJ·mol-1=-91 kJ·mol-1,故该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H=-91kJ·mol-1,C项错;D项,利用题干中的第一个热化学方程式减去第二个热化学方程式得:2Zn(s)+2HgO(s)=2ZnO(s)+2Hg(l) ΔH=-519.4 kJ·mol-1,然后再将各化学计量数缩小一半得Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1,正确。
CH3OH(g) △H=-91kJ·mol-1,C项错;D项,利用题干中的第一个热化学方程式减去第二个热化学方程式得:2Zn(s)+2HgO(s)=2ZnO(s)+2Hg(l) ΔH=-519.4 kJ·mol-1,然后再将各化学计量数缩小一半得Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1,正确。
 CH3OH(g) △H=-91kJ·mol-1,C项错;D项,利用题干中的第一个热化学方程式减去第二个热化学方程式得:2Zn(s)+2HgO(s)=2ZnO(s)+2Hg(l) ΔH=-519.4 kJ·mol-1,然后再将各化学计量数缩小一半得Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1,正确。
CH3OH(g) △H=-91kJ·mol-1,C项错;D项,利用题干中的第一个热化学方程式减去第二个热化学方程式得:2Zn(s)+2HgO(s)=2ZnO(s)+2Hg(l) ΔH=-519.4 kJ·mol-1,然后再将各化学计量数缩小一半得Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH=-259.7 kJ·mol-1,正确。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
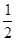 CH4(g)+O2(g)=
CH4(g)+O2(g)= 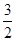 O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1
O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1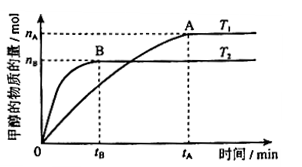
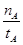 mol·L-1·min-1
mol·L-1·min-1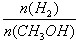 增大
增大 2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
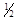 O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。
O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。