题目内容
【题目】铅蓄电池反应为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。下列说法正确的是( )
2PbSO4(s)+2H2O(l)。下列说法正确的是( )
A.放电时Pb为正极,发生还原反应
B.放电时电解质溶液中的H+向负极移动
C.充电时阳极的电极反应为:PbSO4(s)-2e-=Pb(s)+SO![]() (aq)
(aq)
D.充电时阳极附近电解质溶液的pH逐渐减小
【答案】D
【解析】
由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42-+2e-=2H2O+PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,放电时,阴离子向负极移动,阳离子向正极移动,以此解答该题。
A.放电时,该原电池的负极材料是铅,铅失电子发生氧化反应,故A错误;
B.放电时,蓄电池内电路中H+向正极移动,故B错误;
C.充电时阳极发生氧化反应,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故C错误;
D.阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,由电极方程式可知阳极附近电解质溶液的pH逐渐减小,故D正确;
故答案为D。

【题目】氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
![]() 尿素
尿素![]() 与氰酸铵
与氰酸铵![]() 互为 ______ ;氰酸铵属于 ______ 化合物
互为 ______ ;氰酸铵属于 ______ 化合物![]() 选填:“离子”或“共价”
选填:“离子”或“共价”![]() 。
。
![]() 液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量
液氨是一种贮氢材料,气态氨转变为液氨将 ______ 能量![]() 选填:“吸收”或“释放”
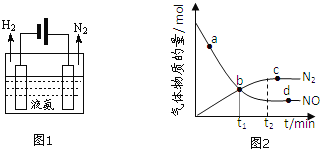
选填:“吸收”或“释放”![]() 液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
液氨可通过图1装置释放氢气,该过程中能量转化方式为 ______ 。
![]() 氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和
氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和![]() ,在一定条件下发生反应:
,在一定条件下发生反应:![]() 。
。
①能说明该反应已达到平衡状态的标志是 ______ ![]() 不定项选择
不定项选择![]() 。
。
![]() 反应速率
反应速率![]()
![]()
![]()
![]() 容器内压强不再随时间而发生变化
容器内压强不再随时间而发生变化
![]() 容器内
容器内![]() 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
![]() 容器内
容器内![]() :
:![]() :
:![]() :
:![]() :4:5:6
:4:5:6
②某次实验中测得容器内NO及![]() 的物质的量随时间变化如图2所示,图中
的物质的量随时间变化如图2所示,图中![]() 正
正![]() 与
与![]() 逆
逆![]() 相等的点为 ______
相等的点为 ______ ![]() 选填字母
选填字母![]() 。
。
![]() 已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
共价键 |
|
|
|
能量变化 | 436 |
| 946 |
则合成氨反应:![]()
![]() ______
______ ![]()
![]() 工业上用氨水吸收硫酸工业尾气中的
工业上用氨水吸收硫酸工业尾气中的![]() ,既可消除污染又可获得
,既可消除污染又可获得![]() 等产品.若用1000kg 含
等产品.若用1000kg 含![]() 质量分数为
质量分数为![]() 的氨水吸收
的氨水吸收![]() 且全部转化为
且全部转化为![]() ,不考虑其它成本,则可获得的利润为 ______ 元
,不考虑其它成本,则可获得的利润为 ______ 元![]() 参照下面的价格表
参照下面的价格表![]() 。
。
| 无水 | |
价格 |
|
|