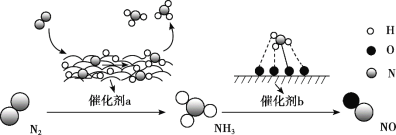
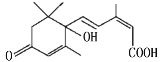
题目内容
【题目】常温下,用0.10molL-1NaOH溶液分别滴定20.00mL0.10molL-1的HX和HY溶液,滴定曲线如图所示。下列说法正确的是( )

A.pH=7时,滴定HX消耗NaOH溶液体积等于20.00mL
B.将上述HX、HY溶液各加水稀释10倍,稀释后溶液的pH:pH(HY)>pH(HX)
C.当NaOH溶液体积为20.00mL时,HX溶液中离子浓度:c(Na+)>c(X-)>c(H+)>c(OH-)
D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,c(H+)+c(HX)=c(OH-)
【答案】D
【解析】
根据图知,未加NaOH溶液时,HY溶液的![]() ,说明HY溶液中
,说明HY溶液中![]() ,则HY是强酸,HX溶液的
,则HY是强酸,HX溶液的![]() ,则HX为弱酸;
,则HX为弱酸;
A.HX为弱酸,NaX溶液呈碱性,如果混合溶液![]() ,说明溶液呈中性,溶液中溶质为HX和NaX,此时酸的体积大于碱,则
,说明溶液呈中性,溶液中溶质为HX和NaX,此时酸的体积大于碱,则![]() ,故A错误;
,故A错误;
B.HX是弱电解质,加水稀释促进HX电离,HY是强酸,完全电离,物质的量浓度相同的HX和HY稀释相同的倍数后![]() :
:![]() ,所以溶液的pH:
,所以溶液的pH:![]() ,故B错误;
,故B错误;
C.当NaOH溶液体积为![]() 时,酸碱恰好完全反应生成NaX,溶液呈碱性,则
时,酸碱恰好完全反应生成NaX,溶液呈碱性,则![]() ,根据电荷守恒得:
,根据电荷守恒得:![]() ,水的电离程度很小,所以离子浓度大小顺序是
,水的电离程度很小,所以离子浓度大小顺序是![]() ,故C错误;
,故C错误;
D.溶液中存在质子守恒,根据质子守恒得![]() ,故D正确;
,故D正确;
故答案为D。

【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程

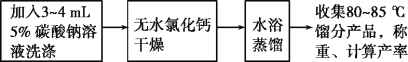
请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。