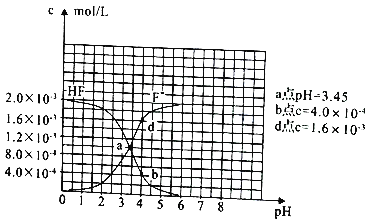
题目内容
【题目】下列离子方程式正确的是( )
A. 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-= BaSO4↓
B. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C. SiO2和氢氧化钠溶液的反应:SiO2+2OH-=SiO32-+H2O
D. 用FeCl3溶液腐蚀铜箔制造印刷电路板:Fe3++Cu=Fe2++Cu2+
【答案】C
【解析】
A.漏写H+与OH-的反应,正确的离子方程式为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4![]() ,错误;
,错误;
B.碳酸钙为难溶物,不能拆分,正确的离子方程式为:CaCO3+2H+=Ca2++CO2![]() +H2O,错误;
+H2O,错误;
C.SiO2和氢氧化钠溶液的反应生成硅酸钠和水,其离子方程式为:SiO2+2OH-=SiO32-+H2O,正确;
D.电荷和转移电子数不守恒,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,错误。

【题目】钴(Co)及其化合物在工业上有广泛应用。利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取CoC12·6H2O粗品的工艺流程图如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、A13+等;
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
请回答下列问题:
(1)上述工艺流程图中操作a的名称:_______________。
(2)写出“浸出”时Co2O3发生反应的离子方程式:____________________。
(3)加入NaC1O3的作用是________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图。使用萃取剂最适宜的pH范围是_________(填字母序号)。
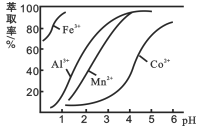
A.2.0~2.5 B. 3.0~3.5 C. 5.0~5.5 D. 9.5~9.8
(5)“除钙”“镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11, Ksp(CaF2)=1.50×10-10。当加入过量NaF,所得滤液中c(Mg2+)/c(Ca2+)=_______________。
【题目】下列实验中的颜色变化,与氧化还原反应无关的是( )
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | 品红溶液中通入足量SO2气体 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 红色褪去 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D