题目内容
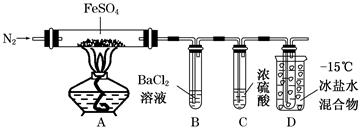
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
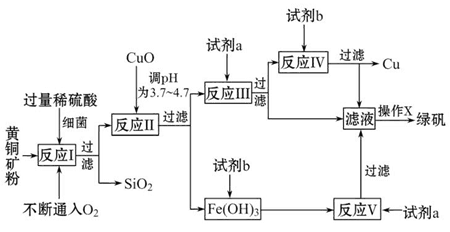
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。

已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。
(1)Fe(或铁) 稀硫酸
(2)冷却结晶 过滤(洗涤干燥)
(3)3.7~4.7
(4)Fe+2Fe3+=3Fe2+
(2)冷却结晶 过滤(洗涤干燥)
(3)3.7~4.7
(4)Fe+2Fe3+=3Fe2+
以黄铜矿为原料进行炼铜,同时得到副产品绿矾的主要流程如下:反应Ⅰ是将CuFeS2转化为CuSO4和Fe2(SO4)3,并过滤除去SiO2。反应Ⅱ是通过水解反应分离CuSO4和Fe2(SO4)3,根据表中给出的数据可知,Fe3+的氢氧化物从开始沉淀到沉淀完全的pH范围是2.7~3.7,Cu2+的氢氧化物从开始沉淀到沉淀完全的pH范围是4.7~6.7,要想将溶液中的Fe3+完全沉淀且Cu2+不能沉淀,需要调节溶液的pH为3.7~4.7;为了不引入新杂质,可以向溶液中加入CuO调节溶液的pH至3.7~4.7,此时Fe3+完全沉淀;最后过滤,即可得到纯净的CuSO4溶液和Fe(OH)3沉淀。由实验目的知,反应Ⅲ是将CuSO4转化为Cu,所以加入的试剂a是过量的Fe,反应后过滤得到FeSO4溶液和Fe、Cu混合物。反应Ⅳ是从Fe、Cu混合物中得到Cu,所以加入的试剂b是稀硫酸。反应Ⅴ是将Fe2(SO4)3转化为FeSO4溶液,发生反应的离子方程式为:Fe+2Fe3+=3Fe2+。操作X是从FeSO4溶液中得到绿矾,操作方法为:蒸发浓缩、冷却结晶、过滤。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
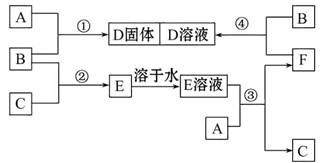

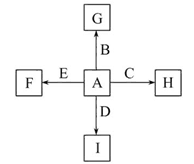
 B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接; 2F+D,F中E元素的质量分数为60%。
2F+D,F中E元素的质量分数为60%。