题目内容
2. I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
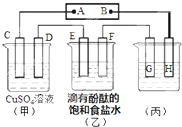
I.已知H2(g)、CO(g)和CH3OH(l)的标准燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;Ⅱ.如图装置所示,C、D、E、F都是惰性电极,甲、乙两溶液的体积和物质的量浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
(1)A极是电源的正极.
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为1:2:2:2.
(3)现用丙装置给铜件镀银,则H应该是镀件(填“镀层金属”或“镀件”),电镀液是硝酸银溶液.当乙中溶液的c(OH-)=0.1mol/L(此时乙溶液体积为500mL),丙中镀件上析出银的质量为5.4g,甲中溶液的c(H+)变大(填“变大”、“变小”或“不变”).
(4)如图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度.则乙装置中,若不考虑Cl2的溶解及与碱的反应,此装置共产生气体17.92L(标准状况).
分析 Ⅰ、根据CO和CH3OH的燃烧热先书写热方程式,再利用盖斯定律来分析甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式;
Ⅱ、(1)将直流电源接通后,F极附近呈红色,说明F电极为阴极,阴极上氢离子放电导致F电极附近呈碱性,则C、E、G为阳极,D、F、H为阴极,阴极连接原电池负极,甲中阳极上OH-放电,阴极上Cu2+放电;
(2)根据转移电子相等进行计算其物质的量之比;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,各个电极上转移的电子数是相等的;
(4)依据电解池中电极反应和电子守恒分析计算.
解答 解:Ⅰ、(2)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
Ⅱ、(1)将直流电源接通后,F极附近呈红色,说明F电极为阴极,阴极上氢离子放电导致F电极附近呈碱性,则C、E、G为阳极,D、F、H为阴极,阴极连接原电池负极,所以B是原电池负极,A为正极,故答案为:正;
(2)C、D、E、F发生的反应分别为:4OH--4e-=2H2O+O2↑、Cu2++2e-=Cu、2Cl--2e-=Cl2↑、2H++2e-=H2↑,串联电路中转移电子相等,假设都转移4mol电子时,O2、Cu、Cl2、H2的物质的量分别是1mol、2mol、2mol、2mol,所以生成单质的物质的量之比为1:2:2:2,故答案为:1:2:2:2;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电解质溶液为硝酸银溶液;当乙中溶液的c(OH-)=0.1mol/L(此时乙溶液体积为500mL)时,根据电极反应2H++2e-═H2↑,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,电解硫酸铜的过程中氢氧根减少,所以氢离子浓度增大,所以酸性增强,甲中溶液的氢离子浓度变大,故答案为:镀件;硝酸银;5.4g;变大;
(4)图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度.则乙装置中,若不考虑Cl2的溶解及与碱的反应,甲装置的电解方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑,乙中电解饱和食盐水发生的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;
甲池溶液通电一段时间后,向所得的溶液中加入0.2mol的Cu(OH)2后恰好恢复到电解前的浓度,发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,由Cu(OH)2$\frac{\underline{\;△\;}}{\;}$CuO+H2O可知电解硫酸铜溶液时生成0.2molCu和0.2mol水被电解,则转移电子物质的量为0.4mol+0.4mol=0.8mol,甲装置中电解硫酸铜转移电子0.4mol,生成0.1mol氧气,电解水中转移电子0.4mol,生成氢气0.2mol,氧气0.1mol,乙装置中每转移0.8电子生成0.4mol氢气和0.4mol氯气,甲装置中共产生气体物质的量为0.4mol,乙装置产生气体物质的量共0.8mol,乙装置生成气体标准状况体积为0.8mol×22.4L/mol=17.92L,
故答案为:17.92.
点评 本题考查学生有关电解池的工作原理知识,综合性很强,难度较大,要求学生熟记教材知识,学以致用,明确原原电池和电解池的工作原理是解题关键,难度中等.

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. | 铝合金的强度和硬度都比纯铝的大 | |
| B. | 铝制的容器可以贮存浓硫酸或浓硝酸 | |
| C. | 铝表面的氧化膜可用盐酸或氢氧化钠溶液除去 | |
| D. | 将金属钠加入到氯化铝溶液中可制得铝 |
| A组 | B组 |
| Ⅰ.H-F键的键能大于H-O键的键能 | ①HF的沸点比H2O低 |
| Ⅱ.H-H…F氢键的键能大于O-H…O氢键的键能 | ②HF比H2O稳定 |
| Ⅲ.HF分子间能形成的氢键个数比H2O分子少 | ③HF的沸点比H2O高 |
| Ⅳ.HF分子与水分子可形成氢键 | ④HF极易溶于水 |
| A. | I② | B. | Ⅱ③ | C. | Ⅲ① | D. | Ⅲ④ |
| A. | 燃烧反应 | B. | 取代反应 | C. | 硝化反应 | D. | 加成反应 |
| A. | 打开啤酒瓶盖后有大量泡沫溢出 | |
| B. | 实验室用排饱和食盐水的方法收集氯气 | |
| C. | 热的纯碱去油污能力更强 | |
| D. | 夏天将食品储藏在冰箱中 |
 和
和
 和
和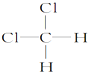
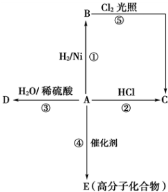 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: ,反应类型加聚反应.
,反应类型加聚反应.