题目内容
【题目】乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取乙酸乙酯用醋酸14.3 mL、95%乙醇23 mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合的氯化钙溶液。主要装置如图所示:
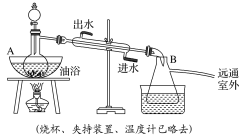
实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135~145 ℃。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是_____。
(2)用饱和Na2CO3溶液洗涤粗酯的目的是______。如果用NaOH溶液代替Na2CO3溶液将引起的后果是____。
(3)用饱和CaCl2溶液洗涤粗酯的目的是_____。
(4)在步骤⑧所得的粗酯里还含有的杂质是____。
【答案】催化剂和吸水剂 与挥发出来的乙酸反应、溶解挥发出来的乙醇,降低乙酸乙酯的溶解度 使挥发出来的乙酸乙酯水解而使实验失败 除去乙醇 水
【解析】
(1)酯化反应中浓硫酸起到催化作用和吸水作用;
(2)饱和碳酸钠溶液能与乙酸反应除去乙酸、溶解乙醇、同时降低乙酸乙酯的溶解度,便于分层;乙酸乙酯在强碱性条件下发生水解反应;
(3)乙醇和氯化钙会能形成络合物,饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇;
(4)饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中还含有水。
:
(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,又因为该反应为可逆反应,浓硫酸吸水后利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂和吸水剂,故答案为:催化剂和吸水剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,同时溶解挥发出来的乙醇,这样更便于闻乙酸乙酯的香味;降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;由于乙酸乙酯在强碱性条件下发生水解反应使最终得不到乙酸乙酯,使实验失败;故答案为:与挥发出来的乙酸反应、溶解挥发出来的乙醇,降低乙酸乙酯的溶解度;使挥发出来的乙酸乙酯水解而使实验失败;
(4)由于乙醇和氯化钙会能形成络合物,故可以用饱CaCl2溶液来吸收乙酸乙酯中可能残留的乙醇,故答案为:除去乙醇;
(5)饱和碳酸钠溶液除掉了乙酸和乙醇,饱和CaCl2溶液可以进一步吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中还含有杂质水,故答案为:水。

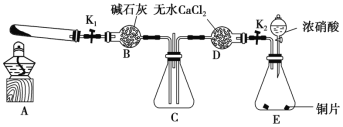
【题目】某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。下列结论中正确的是( )
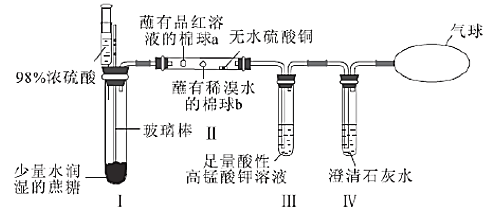
选项 | 现象 | 结论 |
A. | Ⅰ中注入浓硫酸后,可观察到试管中白色固体变为黑色 | 体现了浓硫酸的吸水性 |
B. | Ⅱ中观察到棉球a、b都褪色 | 均体现了SO2的漂白性 |
C. | Ⅱ中无水硫酸铜变蓝 | 说明反应产物中有H2O |
D. | Ⅲ中溶液颜色变浅,Ⅳ中澄清石灰水变浑浊 | 说明有CO2产生 |
A.AB.BC.CD.D
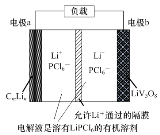
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入物质,发生反应:PCl3(g)+Cl2(g)![]() PCl5(g) ΔH<0,测得反应的相关数据如下:
PCl5(g) ΔH<0,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
温度/℃ | 200 | 300 | 200 |
起始物质投入量 | 1molPCl3、2molCl2 | 2molPCl3、1molCl2 | 2molCl2、2molPCl5 |
平衡c(PCl5)/mol·L-1 | c1 | c2 | c3 |
化学平衡常数 | K1 | K2 | K3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(PCl3) | α2(Cl2) | α3(PCl5) |
下列说法正确的是( )
A.K1<K2
B.c1<c2
C.p3=2p1
D.α1(PCl3)+α3(PCl5)<1