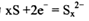题目内容
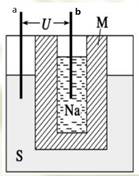
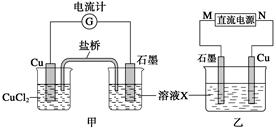
甲、乙两池的电极材料如图所示,请按要求回答下列问题:
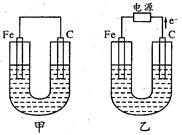
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的 (填“铁”或“碳”)棒;乙池中的 (填
“阴”或“阳”)极。
②乙池中阳极上发生的电极反应方程式是 。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式: 。
②甲池中碳极上电极反应方程式是 ,乙池碳极上
电极反应属于 (填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现
蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的C12和I2物质的量
之比为5:1,且生成HCl和另一种强酸,该强酸的化学式为 。
④若乙池中转移0.1 mol e-后停止实验,池中溶液体积是1L,则溶液混匀后的pH= (不考虑所生成的气体溶解在溶液中的情况)

(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的 (填“铁”或“碳”)棒;乙池中的 (填
“阴”或“阳”)极。
②乙池中阳极上发生的电极反应方程式是 。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式: 。
②甲池中碳极上电极反应方程式是 ,乙池碳极上
电极反应属于 (填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现
蓝色褪去。这是因为过量的Cl2将生成的I2又氧化。若反应的C12和I2物质的量
之比为5:1,且生成HCl和另一种强酸,该强酸的化学式为 。
④若乙池中转移0.1 mol e-后停止实验,池中溶液体积是1L,则溶液混匀后的pH= (不考虑所生成的气体溶解在溶液中的情况)
(1)①碳 阴 ② 4OH- -4e- =2H2O+O2↑
(2) ①2NaCl+2H2O=Cl2↑ +H2↑ +2NaOH
②2H2O+O2+4e-=4OH- 氧化反应
③HIO3 ④13
(2) ①2NaCl+2H2O=Cl2↑ +H2↑ +2NaOH
②2H2O+O2+4e-=4OH- 氧化反应
③HIO3 ④13
试题分析:
甲没有外接电源,所以是原电池,铁作负极,碳作正极;乙有外接电源,所以是电解池,根据电子的流向判断,铁作阴极,碳作阳极;
(1)①甲池中的 正极发生还原反应,有金属析出,所以是碳棒;乙池中的阴极发生还原反应,有金属析出,所以是铁棒;故答案为:碳;阴.
②乙池中阳极上发生氧化反应,氢氧根离子的放电能力大于硝酸根离子的放电能力,所以是氢氧根离子失电子生成氧气和水,故答案为:4OH--4e-═O2↑+2H2O
(2)①氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠.
故答案为:2H2O+2NaCl 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
②在中性溶液中,溶有一定量的氧气,此时会发生吸氧腐蚀,负极上铁失电子,正极上氧气和水得电子生成氢氧根离子,乙池中碳棒作阳极,阳极上发生氧化反应,
故答案为:O2+4e-+2H2O═4OH-;氧化反应。
③乙池碳极附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,故另一种强酸为HIO3。
故答案为:HIO3
④乙池中电解氯化钠溶液时,阳极上氯离子放电,阴极上氢离子放电,所以电池反应式为:2H2O+2NaCl 2NaOH+H2↑+Cl2↑,当有0.1mol电子转移时,生成氢氧化钠的物质的量是0.1mol,则生成氢氧化钠的物质的量浓度=0.1mol/1L=0.1mol/L,则OH-的浓度是0.1mol/L,即pH=13。
2NaOH+H2↑+Cl2↑,当有0.1mol电子转移时,生成氢氧化钠的物质的量是0.1mol,则生成氢氧化钠的物质的量浓度=0.1mol/1L=0.1mol/L,则OH-的浓度是0.1mol/L,即pH=13。
故答案为:13
甲没有外接电源,所以是原电池,铁作负极,碳作正极;乙有外接电源,所以是电解池,根据电子的流向判断,铁作阴极,碳作阳极;
(1)①甲池中的 正极发生还原反应,有金属析出,所以是碳棒;乙池中的阴极发生还原反应,有金属析出,所以是铁棒;故答案为:碳;阴.
②乙池中阳极上发生氧化反应,氢氧根离子的放电能力大于硝酸根离子的放电能力,所以是氢氧根离子失电子生成氧气和水,故答案为:4OH--4e-═O2↑+2H2O
(2)①氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠.
故答案为:2H2O+2NaCl
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑②在中性溶液中,溶有一定量的氧气,此时会发生吸氧腐蚀,负极上铁失电子,正极上氧气和水得电子生成氢氧根离子,乙池中碳棒作阳极,阳极上发生氧化反应,
故答案为:O2+4e-+2H2O═4OH-;氧化反应。
③乙池碳极附近氯离子放电生成氯气,氯气氧化KI生成碘单质遇淀粉变蓝,离子反应为Cl2+2I-═I2+2Cl-,过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,Cl元素的化合价降低,生成盐酸,I元素的化合价升高,由电子守恒可知,5×2×(1-0)=1×2×(x-0),解得x=+5,生成物为碘酸,该化学反应为5Cl2+I2+6H2O═2HIO3+10HCl,故另一种强酸为HIO3。
故答案为:HIO3
④乙池中电解氯化钠溶液时,阳极上氯离子放电,阴极上氢离子放电,所以电池反应式为:2H2O+2NaCl
 2NaOH+H2↑+Cl2↑,当有0.1mol电子转移时,生成氢氧化钠的物质的量是0.1mol,则生成氢氧化钠的物质的量浓度=0.1mol/1L=0.1mol/L,则OH-的浓度是0.1mol/L,即pH=13。
2NaOH+H2↑+Cl2↑,当有0.1mol电子转移时,生成氢氧化钠的物质的量是0.1mol,则生成氢氧化钠的物质的量浓度=0.1mol/1L=0.1mol/L,则OH-的浓度是0.1mol/L,即pH=13。故答案为:13

练习册系列答案
相关题目
 电池工作温度为320℃。下列说法错误的是
电池工作温度为320℃。下列说法错误的是