题目内容
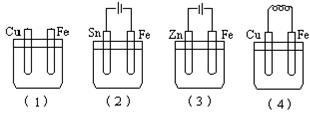
下图装置中盛KOH溶液的部分是一个氢氧燃料电池,对此装置的分析合理的的是


| A.该装置中Cu极为正极 |
| B.一段时间后锌片质量减少 |
| C.b极的电极反应式为H2—2e—=2H+ |
| D.一段时间后,硫酸铜溶液的浓度不变 |
D
试题分析:氢氧燃料电池中,通入氢气的b电极为负极,通入氧气的a电极是正极,右侧装置为电解池,与正极相连的Cu电极为阳极,与负极项链的Zn电极为阴极,故A选项错误;阳极反应式为Cu—2e—=Cu2+,阳离子移向阴极,铜离子比氢离子容易得到电子,则阴极反应式为Cu2++2e—=Cu,所以锌片上镀上一层铜,锌片的质量增大,故B选项错误;KOH溶液显碱性,氢离子不能在碱性溶液中大量共存,则负极反应式为H2—2e—+2OH—=2H2O,故C选项错误;由于阴极消耗的铜离子与阳极生成的铜离子的物质的量相等,则硫酸铜溶液的浓度不变,故D选项正确。

练习册系列答案
相关题目
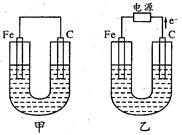
 Li1-xCoO2+LixC6。下列说法正确的是
Li1-xCoO2+LixC6。下列说法正确的是

 MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4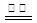 KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是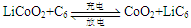 ,下列说法正确的是( )
,下列说法正确的是( )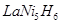 (在反应前后La、Ni的化合价为0),其电池的反应通常表示为:
(在反应前后La、Ni的化合价为0),其电池的反应通常表示为: LaNi5+6Ni(OH)2
LaNi5+6Ni(OH)2