题目内容
按要求填空:
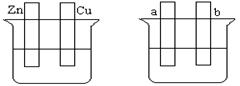
A B
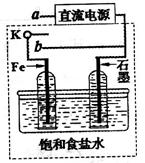
(1)在A图中,稀硫酸为电解质溶液,用导线连接后,铜片电极反应式 。
(2)在B图中外接直流电源,若要在a极镀铜,加以必要的连接后,该装置叫 ,b极电极反应式 。
(3)在B图中外接直流电源,若电极为惰性电极,电解质溶液是CuSO4溶液(足量),电解总反应离子方程式为 ,阴极增重3.2 g,则阳极上放出的气体在标准状况下的体积是_____L,加入一定量的 后(填化学式),溶液能恢复至与电解前完全一致。

A B
(1)在A图中,稀硫酸为电解质溶液,用导线连接后,铜片电极反应式 。
(2)在B图中外接直流电源,若要在a极镀铜,加以必要的连接后,该装置叫 ,b极电极反应式 。
(3)在B图中外接直流电源,若电极为惰性电极,电解质溶液是CuSO4溶液(足量),电解总反应离子方程式为 ,阴极增重3.2 g,则阳极上放出的气体在标准状况下的体积是_____L,加入一定量的 后(填化学式),溶液能恢复至与电解前完全一致。
(1)2H+ +2e=H2↑
(2)电镀池或电镀,Cu - 2e- = Cu2+。
(3)2Cu2++2H2O 2Cu+O2↑+4H+ 0.56 CuO 。
2Cu+O2↑+4H+ 0.56 CuO 。
(2)电镀池或电镀,Cu - 2e- = Cu2+。
(3)2Cu2++2H2O
 2Cu+O2↑+4H+ 0.56 CuO 。
2Cu+O2↑+4H+ 0.56 CuO 。试题分析:(1)A反应为锌铜原电池,锌被氧化成Zn2+进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子,被还原成氢原子。氢原子结合成氢分子从铜片上放出。两极发生如下反应:负极:Zn-2e-=Zn2+ 正极: 2H+ +2e=H2↑ 铜片上的反应为:2H+ +2e=H2↑
(2)电镀的条件为:电源、电极、电解质、闭合回路,,而且题中指出要在a极镀铜,所以此装置为电镀池。要在a极镀铜,那么a极发生的是还原反应,b极发生的是氧化反应,电极反应方程式为:Cu - 2e- = Cu2+.
(3) 在B图中外接直流电源,若电极为惰性电极,电解质溶液是CuSO4溶液(足量),则此反应的离子反应方程式为2Cu2++2H2O
 2Cu+O2↑+4H+,阴极反应方程式为:Cu2++2e-= Cu,又阴极增重3.2g,则增加铜的物质的量为0.05mol,则生成氧气的物质的量为0.05 mol/2="0.025" mol, 生成氧气的体积为0.025 mol×22.4L/ mol=0.56L。该反应析出了单质铜和氧气,根据元素守恒,应向其添加一定量的CuO,溶液能恢复至与电解前完全一致。
2Cu+O2↑+4H+,阴极反应方程式为:Cu2++2e-= Cu,又阴极增重3.2g,则增加铜的物质的量为0.05mol,则生成氧气的物质的量为0.05 mol/2="0.025" mol, 生成氧气的体积为0.025 mol×22.4L/ mol=0.56L。该反应析出了单质铜和氧气,根据元素守恒,应向其添加一定量的CuO,溶液能恢复至与电解前完全一致。
练习册系列答案
相关题目
 。
。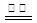 KIO3+3H2↑。下列有关说法不正确的是
KIO3+3H2↑。下列有关说法不正确的是