题目内容
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=196.6 kJ·mol1
2SO3(g) ΔH=196.6 kJ·mol1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=113.0 kJ·mol1
2NO2(g) ΔH=113.0 kJ·mol1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH= kJ·mol1。
SO3(g)+NO(g)ΔH= kJ·mol1。
一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的有 。
A.体系密度保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶5,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
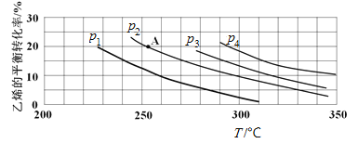
CO在不同温度下的平衡转化率与压强的关系如图所示。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。

(3)如图是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为H2O和 (填化学式)。
②当消耗1 mol NH3和0.5 mol O2时,除去的NO在标准状况下的体积为 L。
(4)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示,写出NO分解的化学方程式 。

【答案】(1)41.8 b 1.8
(2)此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本
(3)①N2 ②11.2
(4)3NO![]() N2O+NO2
N2O+NO2
【解析】本题考查化学平衡状态、平衡常数。(1)由盖斯定律(①②)/2,可得反应的△H=41.8 kJ·mol1;反应物和生成物均为气体,总质量一定,容器容积固定,混合气体的密度始终为定值,不能作为平衡的标志,SO3和NO的体积比为定值,不能作为平衡的标志。由“三段式”
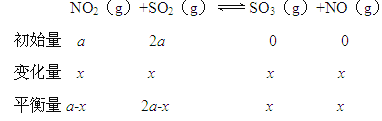
![]() =1∶5,解得x=
=1∶5,解得x=![]() ,K=
,K=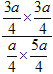 =
=![]() =1.8;
=1.8;
(2)由图像可知,在250℃时、1.3×104kPa时,CO的转化率已经达最大值,故答案为此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本。
(3)由脱硝原理确定从体系中分离出的为生成物,分别为N2和H2O;由电子得失相等计算:O2~2O2,得电子4 mol,0.5 mol氧气反应得到电子2 mol;1 mol NH3转化为N2失去3 mol电子,故NO转化为N2得到电子为1 mol,所以NO的物质的量为0.5 mol,0.5 mol NO标况下体积为11.2 L。
(4)由图象达平衡时X、Y、Z的变化量之比为3∶1∶1,确定方程式为3NO![]() N2O+NO2。
N2O+NO2。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,标准状况下均产生5.6 L气体,则两份铝片的质量之比为
A. 一定为1∶1 B. 可能为2∶3 C. 一定为3∶2 D. 可能为1∶6
【题目】(1)如图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,是图中●、○中的一种。图中●、○分别指代哪种粒子_____________;

(2)H2S和H2O2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2S | 187 | 202 | 2.6 |
H2O2 | 272 | 423 | 以任意比互溶 |
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因________________。
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有____________________(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有___________________。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4H2O晶体。实验中所加C2H5OH的作用是____________________________。