题目内容
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
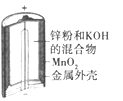
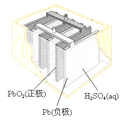
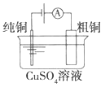
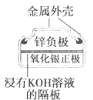
(a)碱性锌锰电池 (b)铅硫酸蓄电池 (c)电解精炼铜 (d)银锌纽扣电池
A.图(a)所示电池中,MnO2的作用是催化剂
B.图(b)所示电池放电过程中,硫酸浓度不断增大
C.图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
【答案】D
【解析】本题主要考查化学电源。碱性锌锰电池中MnO2在正极放电生成MnOOH,故A错;铅蓄电池在放电时,不断消耗硫酸,硫酸浓度减小,故B错;粗铜在阳极溶解时,产生的阳离子除了铜离子还有其他比金属铜活泼的金属阳离子杂质,而阴极析出的只有铜,因此电解一段时间后电解质溶液中Cu2+浓度变小,故C错。答案选D。

【题目】Ⅰ.铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1= a kJmol-1
②PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H2= b kJmol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJmol-1
反应 3PbS(s)+6O2(g)=3PbSO4(s) △H=___________kJmol-1 (用含 a、b、c 的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
Pb(s)+CO2(g) △H,该反应的平衡常数的对数值与温度的关系如下表
温度/℃ | 300 | 727 | 1227 |
1gK | 6.17 | 2.87 | 1.24 |
①该反应的△H__________0(选填“ >”、“< ”或“=”)。
②当1gK=1,在恒容密闭容器中放入足量的PbO并通入CO,达平衡时,混合气体中CO的体积分数为_______________(保留两位有效数字);若平衡后再向容器中充入一定量的CO气体,平衡向_______________(填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_______________(填“增大”、“减小”或“不变”)。
Ⅱ.PbI2可用于人工降雨,可用滴定方法测出PbI2的Ksp。
(3)取一定量的PbI2固体,用蒸馏水配制成饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生:2RH++PbI2=R2Pb2++2H++2I-),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并转入锥形瓶中(如图)。加入酚酞指示剂,用0.0025mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL。确定到滴定终点时锥形瓶中现象为___________________,计算PbI2的Ksp为_______________ 。

【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn、Pb及有机物) 制备NiO并回收金属资源的流程如下所示:

已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | PbS | 8.0×10-28 |
Ni(OH)2 | 2.0×10-15 | NiS | 3.2×10-18 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是________________________。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“加水煮沸”时,反应的化学方程式为_______________________________。
(6)整个流程中,可回收的金属化合物为____________________________________(填化学式)。
(7)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH==Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。



