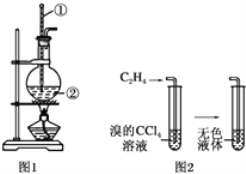
题目内容
【题目】下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=+642 kJmol-1
B.C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ
C.已知:H2(g)+![]() O2(g)═H2O(l) △H=-286 kJmol-1,则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJmol-1
O2(g)═H2O(l) △H=-286 kJmol-1,则:2H2O(l)═2H2(g)+O2(g)的△H=+572 kJmol-1
D.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热)
【答案】C
【解析】
A.放热反应的焓变△H<0,要用负号“-”表示,A错误;
B.反应热单位应该是kJ/mol,B错误;
C.反应物的物质的量增大,反应放出或吸收的热量也要相应的增大,若反应物与生成物颠倒,则反应热数值不变,符号相反,C正确;
D.中和热是在稀溶液中强酸、强碱发生中和反应产生1 mol H2O时放出的热量,上述反应产生2 mol H2O,因此不能表示中和热,D错误;
故合理选项是C。

 阅读快车系列答案
阅读快车系列答案【题目】下列相关实验能达到预期目的是( )
选项 | 实验操作 | 实验目的 |
A | 可逆反应FeCl3(aq)+3KSCN(aq)Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化 | 验证浓度对化学平衡的影响 |
B | 相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和硫酸中,观察气泡产生的快慢 | 验证固体接触面积对化学反应速率的影响 |
C | 相同温度下,两只试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量MnO2固体 | 验证不同催化剂对H2O2分解速率的影响 |
D | 将SO2气体通入溴水中,观察溶液颜色的变化 | 证明SO2具有漂白性 |
A.AB.BC.CD.D