题目内容
(每空2分,共8分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:
2C4H10+26CO32--52e-=34CO2+10H2O
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
2C4H10+26CO32--52e-=34CO2+10H2O
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
(每空2分,共8分)(1) 2C4H10+13O2=8CO2+10H2O ;
(2) O2+2CO2+4e-=2CO32- 。(3) CO2 , 负极反应产物
(2) O2+2CO2+4e-=2CO32- 。(3) CO2 , 负极反应产物
(1)原电池中负极失去电子,正极得到电子,所以丁烷在负极通入,氧气在正极通入,所以总反应式为2C4H10+13O2=8CO2+10H2O。
(2)总反应式减去负极电极反应式即得到正极电极反应式,即正极反应式为O2+2CO2+4e-=2CO32-。
(3)根据正极反应式可知,正极消耗CO2,所以必需在正极加入CO2补充。由于负极产生CO2,所以加入的CO2可来自于负极产生的CO2。
(2)总反应式减去负极电极反应式即得到正极电极反应式,即正极反应式为O2+2CO2+4e-=2CO32-。
(3)根据正极反应式可知,正极消耗CO2,所以必需在正极加入CO2补充。由于负极产生CO2,所以加入的CO2可来自于负极产生的CO2。

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
 M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。
M+Ni(OH)2,M为储氢合金,MH为吸附了氢原子的储氢合金。电解质溶液为浓KOH溶液。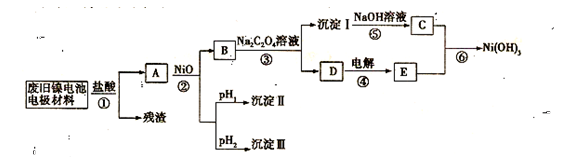


 ,
,

 ,则氢气的燃烧热
,则氢气的燃烧热