题目内容
17.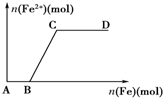 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )| A. | AB段铁元素以①形式存在 | B. | CD段铁元素以③形式存在 | ||
| C. | BC段铁元素以④形式存在 | D. | 以上说法均不正确 |
分析 在一定量的稀HNO3中缓慢加入铁粉,开始时反应Fe+4HNO3═Fe(NO3)3+NO↑+2H2O此时铁元素在溶液中以Fe3+存在,在B点时,硝酸恰好反应完全,即AB段;
继续加铁粉,发生Fe+2Fe3+═3Fe2+,此时溶液中Fe2+的量逐渐增多,Fe3+的量逐渐减少,即BC段;
在C点时,溶液中的Fe3+恰好完全反应,此时继续加入的铁粉不再反应,溶液中的Fe2+的量不再增多,即CD段.据此分析.
解答 解:在一定量的稀HNO3中缓慢加入铁粉,开始时反应Fe+4HNO3═Fe(NO3)3+NO↑+2H2O此时铁元素在溶液中以Fe3+存在,在B点时,硝酸恰好反应完全;
继续加铁粉,发生Fe+2Fe3+═3Fe2+,此时溶液中Fe2+的量逐渐增多,Fe3+的量逐渐减少,即BC段;
在C点时,溶液中的Fe3+恰好完全反应,此时继续加入的铁粉不再反应,溶液中的Fe2+的量不再增多,即CD段.
A、在一定量的稀HNO3中缓慢加入铁粉,开始发生的反应为:Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,则在AB段铁元素①Fe3+以形式存在,故A正确;
B、在C点时,溶液中的Fe3+恰好完全反应,此时继续加入的铁粉不再反应,溶液中的Fe2+的量不再增多,此时铁元素以③Fe、Fe2+的形式存在,故B正确;
C、在B点时,硝酸恰好反应完全,继续加Fe,部分铁离子与Fe反应生成亚铁离子,发生反应:Fe+2Fe3+═3Fe2+,则溶液中存在④Fe2+、Fe3+,故C正确;
D、综上分析可知,ABC均正确,故D错误.
故选D.
点评 本题考查了混合物的定性分析,明确图象中每段发生的化学反应是解答本题的关键,难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
8.下列反应属于取代反应的是( )
| A. | 甲烷燃烧 | B. | 乙烯与溴水反应 | ||
| C. | 甲烷与氯气在光照下反应 | D. | 甲烷制炭黑 |
12.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:K+、Fe2+、MnO4-、SO42- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | pH=12的溶液中:K+、Na+、Br-、AlO2- | |
| D. | 与铝反应生成H2的溶液中:NH4+、K+、Cl-、SiO32- |
2.电子层数相同的X、Y、Z三种元素,原子序数都小于18,已知最高价氧化物对应水化物的酸性是HXO4>H2YC4>H3ZO4,则下列判断错误的是( )
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性:HX>H2Y>ZH3 | ||
| C. | 非金属性:X>Y>Z | D. | 阴离子的还原性:Z3->Y2->X- |
9.将下列各组物质按单质、氧化物、酸、碱分类顺序排列,其中正确的是( )
| A. | 氧气、干冰、硫酸、烧碱 | B. | 碘酒、冰、盐酸、烧碱 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱 | D. | 铜、硫酸钠、醋酸、石灰水 |
7.工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2(g)+O2(g)?2SO3(g),这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂是为了加快反应速率和提高SO2的转化率 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度不变 | |
| C. | 达到平衡时,v(SO2)正=v(O2)逆 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |