题目内容
2.电子层数相同的X、Y、Z三种元素,原子序数都小于18,已知最高价氧化物对应水化物的酸性是HXO4>H2YC4>H3ZO4,则下列判断错误的是( )| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性:HX>H2Y>ZH3 | ||
| C. | 非金属性:X>Y>Z | D. | 阴离子的还原性:Z3->Y2->X- |
分析 最高价氧化物对应水化物的酸性是HXO4>H2YC4>H3ZO4,则X、Y、Z的化合价分别为+7、+6、+5;X、Y、Z三种元素的原子序数都小于18,且电子层相同,由于O元素没有最高正价,则Y为S元素,所以X为Cl、Z为P元素;同周期元素的原子从左到右,原子半径逐渐减小、元素非金属性增强、氢化物的稳定性逐渐增强、阴离子还原性减弱,据此进行判断.
解答 解:最高价氧化物对应水化物的酸性是HXO4>H2YC4>H3ZO4,则X、Y、Z的最高化合价分别为+7、+6、+5;X、Y、Z三种元素的原子序数都小于18,且电子层相同,由于O元素没有最高正价,则Y为S元素,所以X为Cl、Z为P元素,
A.电子层相同时,核电荷数越大,原子半径越小,则原子半径大小为:P>S>Cl,故A错误;
B.非金属性越强,氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故B正确;
C.最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故C正确;
D.元素非金属性越强,阴离子的还原性越弱,由于非金属性X>Y>Z,所以阴离子的还原性Z3->Y2->X-,故D正确;
故选A.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,明确原子结构与元素周期律、元素周期表的关系为的关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
16.根据下列反应,判断氧化剂的氧化性强弱顺序为( )
①H2S+Cl2═S+2HCl
②2NaI+Cl2═2NaCl+I2
③Na2S+I2═2NaI+S.
①H2S+Cl2═S+2HCl
②2NaI+Cl2═2NaCl+I2
③Na2S+I2═2NaI+S.
| A. | Cl2>I2>S | B. | Cl2>S>I2 | C. | I2>Cl2>S | D. | S>I2>Cl2 |
13.下列物质都能与Na反应放出H2,其产生H2的速率排列顺序正确的是( )
①C2H5OH
②CH3COOH溶液
③H2O.
①C2H5OH
②CH3COOH溶液
③H2O.
| A. | ①>②>③ | B. | ②>①>③ | C. | ③>①>② | D. | ②>③>① |
10.可逆反应:3A(g)?3B(?)+C(?)△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是( )
| A. | B和C可能都是固体 | B. | 若C为固体,则B一定是气体 | ||
| C. | B和C一定都是气体 | D. | B和C不可能都是气体 |
17.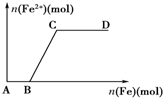 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )| A. | AB段铁元素以①形式存在 | B. | CD段铁元素以③形式存在 | ||
| C. | BC段铁元素以④形式存在 | D. | 以上说法均不正确 |
7.如图所示,试管中盛有已检出部分离子的某溶液.下列推测正确的是( )


| A. | 该溶液中还可能大量存在MnO4-、ClO- | |
| B. | 向该溶液中加入少量FeI2,发生反应的离子方程式为2NO3-+6I-+8H+═2NO↑+3I2+4H2O | |
| C. | 向该溶液中逐滴加入Na2CO3溶液至过量的过程中既有气体逸出又有沉淀生成 | |
| D. | 向该溶液中加入少量Mg一定有H2逸出 |
14.向NaCN的水溶液中加入下列物质,可使NaCN水解程度增大的是( )
①NaOH ②NaCN ③NH4Cl ④Na2CO3 ⑤H2O ⑥HCN ⑦HCl.
①NaOH ②NaCN ③NH4Cl ④Na2CO3 ⑤H2O ⑥HCN ⑦HCl.
| A. | ①②③ | B. | ①⑤⑥ | C. | ①③⑤ | D. | ③⑤⑦ |
11.下列关于反应热的说法正确的是( )
| A. | 可逆反应“CO(g)+H2O(g)═CO2(g)+H2(g)”中的△H小于0,说明此反应为吸热反应 | |
| B. | 已知S(s)+O2(g)═SO3(g)的反应热为△H═-385.5kJ•mol-1,说明硫的燃烧热为385.5 kJ•mol-1 | |
| C. | 一个化学反应的反应热等于反应物的总能量减去生成物的总能量 | |
| D. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关 |
12.下列说法正确的是( )
| A. | 向Na2SO4溶液中加入过量BaCl2溶液,则SO42-沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO42- | |
| B. | Ksp小的物质的溶解能力一定比Ksp大的物质的小 | |
| C. | 为减小洗涤过程中固体的损失,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀 | |
| D. | 洗涤沉淀时,洗涤次数越多越好 |