题目内容
17.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9.单质Y和W都可与浓的NaOH溶液反应.请回答下列问题:(1)X、Y、Z、W的元素符号分别为Be,Al,S,Cl.
(2)ZW2的电子式是
 ,所含化学键类型为共价键.
,所含化学键类型为共价键.(3)工业电解熔融Y的氧化物生产单质Y,其化学反应方程式为2Al2O3电解_4Al+3O2↑.
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是Be+2NaOH=Na2BeO2+H2↑.
分析 X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,结合原子序数显然X是Be,四元素有两种为金属,则Y、Z、W一定处于第三周期,X与W原子的最外层电子数之和为9,则W处于ⅦA族,为Cl元素;Y与Z原子的最外层电子数之和为9,则Y处于ⅢA族、Z处于ⅥA族,故Y为Al元素、Z为S元素,Al、氯气都可与浓的NaOH溶液反应,符合题意,据此解答.
解答 解:X原子的最外层电子数与次外层电子数相等,短周期中只有Be和Ar,结合原子序数显然X是Be,四元素有两种为金属,则Y、Z、W一定处于第三周期,X与W原子的最外层电子数之和为9,则W处于ⅦA族,为Cl元素;Y与Z原子的最外层电子数之和为9,则Y处于ⅢA族、Z处于ⅥA族,故Y为Al元素、Z为S元素,Al、氯气都可与浓的NaOH溶液反应,符合题意.
(1)由上述分析可知,X、Y、Z、W的元素符号分别为 Be、Al、S、Cl,
故答案为:Be;Al;S;Cl;
(2)ZW2为SCl2,分子中S一再与氯原子之间形成1对共用电子对,其电子式为 ,含有共价键,
,含有共价键,
故答案为: ;共价键;
;共价键;
(3)工业电解熔融氧化铝生产单质Al,其化学反应方程式为:2Al2O3电解_4Al+3O2↑,
故答案为:2Al2O3电解_4Al+3O2↑;
(4)Be与Al化学性质相似,则Be与浓的NaOH溶液反应的化学方程式是:Be+2NaOH=Na2BeO2+H2↑,
故答案为:Be+2NaOH=Na2BeO2+H2↑.
点评 本题考查结构性质位置关系综合应用,难度中等,推断元素是解题关键,推断的突破口是“X原子的最外层电子数与次外层电子数相等”.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
8.活泼金属氢化物是火箭燃料的重要供氢剂,如氢化钠、氢化钙等.例如,氢化钙的供氢原理是CaH2+2H2O=Ca(OH)2+2H2下列有关分析中正确的是( )
| A. | 氢化钙中含共价键,水中含非极性键 | |
| B. | 水分子和氢分子中都存在氢氢非极性共价键 | |
| C. | 氢氧化钙只存在离子键 | |
| D. | 该反应断裂离子键和共价键,生成离子键和共价键 |
5.下列说法中,不正确的是( )
| A. | 氯气可用于消毒和制造漂白粉 | B. | 氨气可用于制造氮肥 | ||
| C. | 乙烯可用于制造塑料 | D. | 铝制容器可用于盛放稀硫酸 |
12.下列说法中正确的是( )
| A. | 难失电子的原子,获得电子的能力一定强 | |
| B. | 易得电子的原子所形成的简单阴离子,其还原性一定强 | |
| C. | 完全由非金属元素构成的化合物一定是共价化合物 | |
| D. | 离子化合物在熔融状态下都能导电 |
2.铜锌合金的颜色酷似金的颜色,所以近来用铜锌合金制成的假金元宝欺骗行人的事件屡有发生.要检验市面上的金首饰是否为纯金或者真金,可取样品与一种试剂进行反应,根据现象即可判断,所取的试剂不能是( )
| A. | 硫酸 | B. | “王水” | C. | 盐酸 | D. | 硝酸 |
6.已知:1mol H2(g)与1mol Br2(g)完全反应生成2mol HBr(g)时放出72kJ的热量,有关物质的相关数据如下表:
则表中a为( )
| 化学键 | H2(g) | Br2(g) | HBr(g) |
| 断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 260 | C. | 230 | D. | 200 |
7.下列反应中生成物总能量高于反应物总能量的氧化还原反应是( )
| A. | CO2与C反应 | B. | Al与稀盐酸反应 | ||
| C. | CaCO3受热分解 | D. | Ba(OH)2?8H2O与NH4Cl固体反应 |

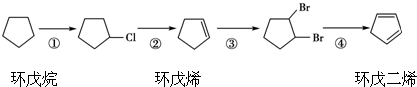
 ,
,
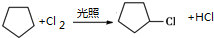 ;(方程式中物质可用键线式表示,下同)
;(方程式中物质可用键线式表示,下同) ;
;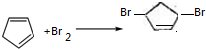 .
.
