题目内容
常温时,下列有关于电解质溶液的叙述正确的是( )
分析:A、c(H+).C(OH-)=KW,稀释氨水,C(OH-)减小,故c(H+)增大;
B、pH均为5的盐酸,酸中的氢离子抑制了水的电离,氯化铵溶液中,铵离子水解,大大促进了水的电离;
C、KW与溶液的浓度无关,受温度影响,向水中加入少量固体硫酸氢钠,硫酸是强电解质,电离出大量氢离子,溶液显示酸性,c(H+)增大;
D、醋酸是弱电解质,部分电离;硫酸是强电解质,完全电离,pH相同的硫酸和醋酸,c(醋酸)远远大于c(硫酸).
?
B、pH均为5的盐酸,酸中的氢离子抑制了水的电离,氯化铵溶液中,铵离子水解,大大促进了水的电离;
C、KW与溶液的浓度无关,受温度影响,向水中加入少量固体硫酸氢钠,硫酸是强电解质,电离出大量氢离子,溶液显示酸性,c(H+)增大;
D、醋酸是弱电解质,部分电离;硫酸是强电解质,完全电离,pH相同的硫酸和醋酸,c(醋酸)远远大于c(硫酸).
?
解答:解:A、一定温度下,水的电离常数不变,KW=c(H+)?C(OH-),氨水是弱电解质,稀释后溶液的pH减小,C(OH-)减小,KW不变,所以C(OH-)增大,故A错误;
B、盐酸属于强电解质,pH为5的盐酸中,酸中的氢离子抑制了水的电离,使得水的电离程度降低;氯化铵是强酸弱碱盐,溶液中,铵离子水解,会大大促进了水的电离,所以他们的电离程度不同,故B错误;
C、硫酸氢钠是强电解质,加入水中后,溶液中c(H+)会大大增加;KW与溶液的浓度无关,只受温度影响,故C正确;
D、由于醋酸是弱电解质,在溶液中部分发生电离;硫酸是强电解质,完全电离,pH相同的硫酸和醋酸,c(醋酸)会远远大于c(硫酸),同体积的两溶液中,n(醋酸)>n(硫酸),所以醋酸消耗的NaOH的物质的量多,故D错误.
故选C.
B、盐酸属于强电解质,pH为5的盐酸中,酸中的氢离子抑制了水的电离,使得水的电离程度降低;氯化铵是强酸弱碱盐,溶液中,铵离子水解,会大大促进了水的电离,所以他们的电离程度不同,故B错误;
C、硫酸氢钠是强电解质,加入水中后,溶液中c(H+)会大大增加;KW与溶液的浓度无关,只受温度影响,故C正确;
D、由于醋酸是弱电解质,在溶液中部分发生电离;硫酸是强电解质,完全电离,pH相同的硫酸和醋酸,c(醋酸)会远远大于c(硫酸),同体积的两溶液中,n(醋酸)>n(硫酸),所以醋酸消耗的NaOH的物质的量多,故D错误.
故选C.
点评:本题考查的是弱电解质在水溶液中的电离平衡,及水的离子常数,涉及内容比较全面,注重了基础知识的考查.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
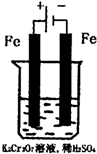 环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO
环境中常见的重金属污染有:汞、铅、锰、铬、镉.处理工业废水中常含有的Cr2O72-和CrO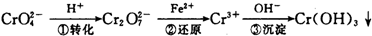
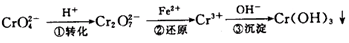

 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)


 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)