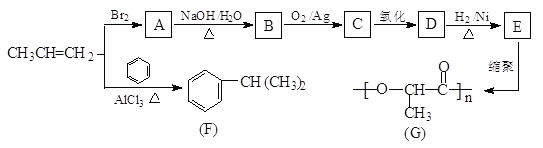
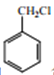
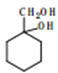
题目内容
【题目】炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用。其流程图如下。已知FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。

金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高浸出率可以采用的方法是(写出其中一点即可)______________。
(2)滤液I中有少量的AsO33-,若不除去,则AsO33-与Cd反应会产生一种有毒氢化物气体,该气体的分子式为_________。向滤液I中逐滴滴人酸性KmnO4溶液可与AsO33-发生反应生成FeAsO4,完成该反应的离子方程式:_________
___Fe2++___AsO33-+___MnO4-+ □= Mn2++ FeAsO4↓+ □,判断该滴定终点的现象是_______。
(3)流程中②调节pH时可以选用的试剂为________,滤渣Ⅱ的主要成份为________。
(4)常温下Zn(OH)2的溶度积Ksp=_____________________。
(5)制得的ZnSO4 7H2O需洗涤,洗涤晶体时应选用试剂为________________。
【答案】 适当增大硫酸浓度/升高溶液温度/搅拌/将铜镉渣磨碎成小颗粒等合理答案均可以 AsH3 5Fe2++5AsO33-+3MnO4- +14H+==3Mn2++5FeAsO4+7H2O 滴最后一滴高锰酸钾,溶液变为粉红色且半分钟内不恢复为原色,则反应到终点 ZnO/ZnCO3/Zn(OH)2等合理答案均可 FeAsO4 Fe(OH)3 10-17 乙醇 或饱和硫酸锌溶液
【解析】(1)可以通过适当增大硫酸浓度、升高溶液温度、搅拌、将铜镉渣磨碎成小颗粒等措施提高浸出率;
(2 )AsO33-与Cd反应,Cd被氧化,则AsO33-被还原为一种有毒氢化物气体,此气体的分子式为AsH3 ;向滤液I中逐滴滴人酸性KMnO4溶液可与AsO33-发生反应生成FeAsO4,根据电子守恒、电荷守恒及原子守恒得此反应的离子方程式为5Fe2++5AsO33-+3MnO4- +14H+==3Mn2++5FeAsO4+7H2O,当滴最后一滴高锰酸钾,溶液变为粉红色且半分钟内不恢复为原色,则反应到终点;
(3)流程中②调节pH时,选用的试剂要能与H+反应,同时不引入新的杂质,则可选用的试剂为ZnO、ZnCO3或Zn(OH)2;由图示可知,当溶液pH=4时,溶液中的Fe3+水解完全转化为 Fe(OH)3,则滤渣Ⅱ的主要成份为 Fe(OH)3;
(4)沉淀完全时溶液pH=8,即c(OH-)=1×10-6mol/L,此时溶液中c(Zn2+)浓度为1×10-5mol/L,常温下Zn(OH)2的溶度积Ksp=c(Zn2+)×c2(OH-)=1×10-17;
(5)因ZnSO4·7H2O易溶于水,难溶于酒精,制得的ZnSO4 7H2O晶体可选择酒精或饱和硫酸锌溶液洗涤。