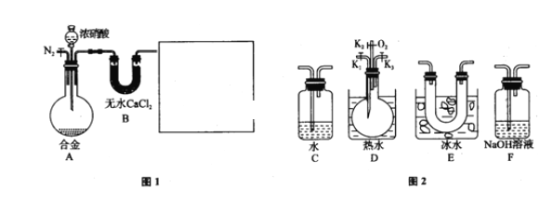
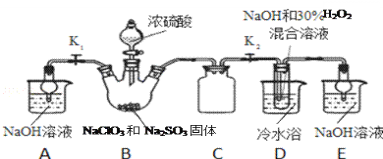
题目内容
【题目】下列物质的性质是由分子间作用力决定的是
A.氧化铝的熔点很高B.晶体硅的硬度很大
C.干冰容易升华D.水受热难分解
【答案】C
【解析】
A.氧化铝为离子化合物,离子键是一种强的相互作用,使得氧化铝的熔点很高,与分子间作用力无关,故A不选;
B.晶体硅是原子晶体,共价键是一种强的相互作用,使得硅晶体的硬度很大,与分子间作用力无关,故B不选;
C.干冰是分子晶体,分子间作用力是一种弱的相互作用,使得干冰容易升华,与分子间作用力有关,故C选;
D.水分子中存在共价键,共价键是一种强的相互作用,导致水受热难分解,与分子间作用力无关,故D不选;
故选C。

【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。

①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随温度升高而增大,490K之后,甲醇产率随温度升高而减小的原因分别是____。
②一定能提高甲醇产率的措施是____。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。

①490K时,根据曲线a、c判断合成甲醇的反应机理是____(填“I”或“II”)。
Ⅰ.CO2![]() CO
CO![]() CH3OH II.CO
CH3OH II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因____。
【题目】下表中是各组反应的反应物和反应温度,反应刚开始时,放出H2速率最快的是( )
编号 | 金属(粉末状) | 物质的量(mol) | 酸的浓度及体积 | 反应温度(℃) |
A | Al | 0.1 | 2mol.L-1盐酸10mL | 60 |
B | Fe | 0.1 | 1mol.L-1盐酸10mL | 50 |
C | Mg | 0.1 | 1mol.L-1盐酸10mL | 60 |
D | Mg | 0.1 | 1mol.L-1硫酸10mL | 60 |
A.AB.BC.CD.D