题目内容
【题目】铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)基态铁原子的价电子轨道表示式为__。铁、铬、锰属于周期表中的___区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___(填元素符号),原因为___。
(3)化学式为CrC13·6H2O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO3溶液,所得AgC1沉淀的物质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___。
②H2O分子的VSEPR模型为___。
(4)MnF2和MnCl2均为离子化合物,MnF2的熔点高于MnCl2熔点的原因为___。
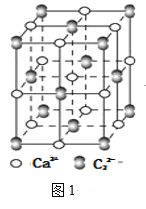
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
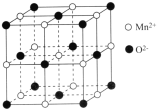
①该晶胞中由O2-形成的正八面体空隙数目为__。
②设NA为阿伏加德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度ρ=____g·cm-3。(用含a、NA的代数式表示)。
【答案】![]() d Mn 基态Mn原子的核外电子排布式为[Ar]3d54s2,4s能级是全满结构,更稳定,失去一个电子所需能量更高 [Cr(H2O)5C1]2+ 四面体形 F-半径更小,MnF2的晶格能更大,熔点更高 4
d Mn 基态Mn原子的核外电子排布式为[Ar]3d54s2,4s能级是全满结构,更稳定,失去一个电子所需能量更高 [Cr(H2O)5C1]2+ 四面体形 F-半径更小,MnF2的晶格能更大,熔点更高 4 ![]()
【解析】
(1)铁元素的原子序数为26,价电子排布式为3d64s2,铁、铬、锰都是第四周期的过渡元素;
(2)铬原子价电子排布式为3d54s1,锰原子价电子排布式为3d54s2,Mn原子的4s能级是全充满结构;
(3)①由相同物质的量的甲、乙、丙的水溶液中加入足量的AgNO3溶液,析出AgCl的物质的量之比分别为2:1:3可知,暗绿色配合物的6个配体为1个氯离子和5个水分子;
②水分子中氧原子的价层电子对数为4;
(4)离子晶体的晶格能越大,离子键越强,晶体的熔沸点越高;
(5)①八面体间隙原子处于八面体间隙中心,即处于面心立方晶胞的体心和棱边的中心;
②由分摊法计算可得。
(1)铁元素的原子序数为26,位于元素周期表中第四周期Ⅷ族,价电子排布式为3d64s2,价电子轨道表示式为![]() ;铁、铬、锰都是第四周期的过渡元素,属于周期表中的d区元素,故答案为:
;铁、铬、锰都是第四周期的过渡元素,属于周期表中的d区元素,故答案为:![]() ;d;
;d;
(2)铬元素的原子序数为24,价电子排布式为3d54s1,锰元素的原子序数为25,价电子排布式为3d54s2,Mn原子的4s能级是全充满结构,结构更稳定,失去一个电子所需能量更高,则基态锰原子的第一电离能大于基态铬原子,故答案为:Mn;基态Mn原子的核外电子排布式为[Ar]3d54s2,4s能级是全满结构,更稳定,失去一个电子所需能量更高;
(3)①由相同物质的量的甲、乙、丙的水溶液中加入足量的AgNO3溶液,析出AgCl的物质的量之比分别为2:1:3可知,暗绿色配合物的6个配体为1个氯离子和5个水分子,则暗绿色的配合物内界的化学式为[Cr(H2O)5C1]2+,故答案为:[Cr(H2O)5C1]2+;
②水分子中氧原子的价层电子对数为4,则水分子的VSEPR模型为正四面体形,故答案为:正四面体形;
(4)离子晶体的晶格能越大,离子键越强,晶体的熔沸点越高,MnF2和MnCl2均为离子化合物,F—离子的离子半径小于Cl—离子,MnF2的晶格能大于MnCl2,离子键更强,晶体的熔沸点更高,更答案为:F-半径更小,MnF2的晶格能更大,熔点更高;
(5)①由晶胞结构可知,一氧化锰为为面心立方结构,晶胞中由O2-形成的正八面体存在八面体间隙,八面体间隙原子处于八面体间隙中心,即处于面心立方晶胞的体心和棱边的中心,则晶胞中的八面体间隙数为4,故答案为:4;
②由晶胞结构可知,晶胞中Mn2+离子的个数为8×![]() +6×
+6×![]() =4,则晶胞中含有4个MnO,晶胞的质量为
=4,则晶胞中含有4个MnO,晶胞的质量为![]() g,由晶胞中距离最近的两个O2-之间的距离为apm可知,晶胞的边长为
g,由晶胞中距离最近的两个O2-之间的距离为apm可知,晶胞的边长为![]() a×10—10cm,晶胞的体积为(
a×10—10cm,晶胞的体积为(![]() a×10—10)3cm3,则MnO晶体的密度ρ为
a×10—10)3cm3,则MnO晶体的密度ρ为![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。

【题目】氢气是一种清洁能源。制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。(1)用甲烷制取氢气的两步反应的能量变化如下图所示:
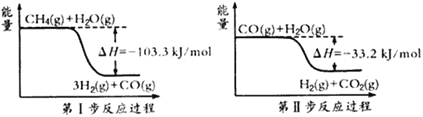
①甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________。
②第Ⅱ步反应为可逆反应。800℃时,若CO的起始浓度为2.0 mol·L-1,水蒸气的起始浓度为3.0 mol·L-1,达到化学平衡状态后,测得CO2的浓度为1.2 mol·L-1,则CO的平衡转化率为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B元素的化合价不变,该反应的化学方程式为___________________,反应消耗1mol NaBH4时转移的电子数目为_______。
(3)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。
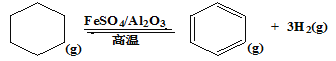
在某温度下,向恒容容器中加入环已烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=____________________(用含a、b的关系式表达)。
(4)一定条件下,如下图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其它有机物生成)。
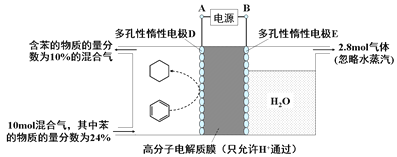
①实现有机物储氢的电极是________;
A.正极 | B.负极 | C.阴极 | D.阳极 |
其电极反应方程为:________________________。
②该储氢装置的电流效率η明显小于100%,其主要原因是相关电极除目标产物外,还有一种单质气体生成,这种气体是_________。由表中数据可知,此装置的电流效率η=______________。[η=(生成目标产物消耗的电子数/转移的电子总数)×100%,计算结果保留小数点后1位]。
【题目】当氨分子中的三个氢原子依次被其它原子或基团取代时,所形成的化合物叫做氨的衍生物。主要有N2H4(肼)、HN3(叠氮化氢,溶于水称为叠氮酸)、NH2OH(羟胺)。水合肼(N2H4·H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。下面是工业水合肼法制备叠氮化钠的工艺流程。
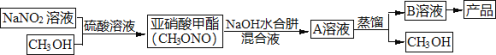
资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
I.合成水合肼。实验室合成水合肼装置如下图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在400C以下反应一段时间后,再迅速升温至1100℃继续反应可以制得水合肼。
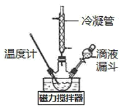
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO碱性溶液,不能反向滴加的原因是______________;制取N2H4H2O的离子方程式为_______________________。
II.制备叠氮化钠。实验室可利用下图中所示的装置及药品制备叠氮化钠。
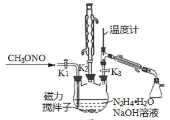
(2)①根据实验发现温度在20℃左右反应的转化率最高,因此可釆取的措施是_______________;流程中蒸馏A溶液时,装置中旋塞K1、K2、K3的开关情况是_______________________。
②写出该方法制备叠氮化钠的化学方程式:________________________。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为____________________,减压过滤,晶体用乙醇洗涤23次后,干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5molL的NaClO溶液_____________mL。
III.羟胺(NH2OH)是一种还原剂,可以通过下列过程得到:乙烯和N2O4气体混合后,光照,发生加成反应,得到化合物A。A结构对称,所有相同元素的原子化学环境相同。A在某浓度的硫酸溶液中回馏,可得到化合物B,同时得到CO和CO2组成的混合气体(相对氢气密度为18)。经分析,B为不含碳元素的硫酸盐,其硫和氧元素的质量分数分别为19.51%和58.54%。若将A换成CH3CH2NO2进行类似的反应,也能得到B,但没有气体放出。B在液氨中即得到NH2OH。
(5)NH2OH具有弱碱性,可与酸反应生成盐,该盐阳离子的电子式为_______________。
(6)写出A→B的化学方程式________________________。
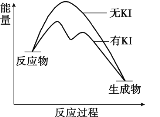
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性