题目内容
硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
(1)工业制硫酸的过程中,SO2被氧气氧化的化学方程式为 。
(2)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。
已知:25℃时,H2SO3  HSO3 -+H+ K=1.5×10-2
HSO3 -+H+ K=1.5×10-2
H2CO3 HCO3 -+H+ K=4.4×10-7
HCO3 -+H+ K=4.4×10-7
下列试剂中适合用作该法吸收剂的是 (填字母序号)。
a.石灰乳 b. Na2SO3溶液 c. Na2CO3溶液
②“钠碱法”用NaOH溶液作吸收剂,向100 mL 0.2 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,反应后测得溶液pH<7,则溶液中下列各离子浓度关系正确的是 (填字母序号)。
a.c(HSO3-)> c(SO32-)> c(H2SO3)
b.c(Na+)>c(HSO3-)> c(H+)> c(SO32-)
c.c(Na+)+c(H+)= c(HSO3-)+c(SO32-)+c(OH-)
(3)某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下: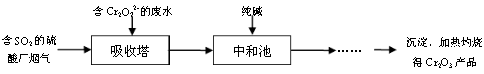
①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为 。
②中和池中的反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式为 。
(1)2SO2+O2 2SO3(2分,写“高温”不扣分,既不写条件也不写可逆号的只扣1分)
2SO3(2分,写“高温”不扣分,既不写条件也不写可逆号的只扣1分)
(2)①a、b、c(2分,只选一个为0分,选两个给1分)
②a、b(2分,只选对一个为1分,选对一个选错一个为0分)
(3)①Cr2O72-+2H++3SO2=2Cr3++3SO42-+H2O(2分) ②CO2(1分)
解析试题分析:(1)SO2被氧气氧化生成SO3,化学方程式为:2SO2+O2 2SO3
2SO3
(2)①SO2可以分别与Ca(OH)2、Na2SO3、Na2CO3反应,所以a、b、c项都可以用来吸收SO2。
②NaOH为0.02mol,SO2为0.02mol,二者恰好生成NaHSO3,因为HSO3?的电离程度大于水解程度,所以 c(HSO3-)> c(SO32-)> c(H2SO3),a项正确;HSO3?和H2O电离都可生成H+,所以 c(Na+)>c(HSO3-)> c(H+)> c(SO32-),故b项正确;根据电荷守恒可知: c(Na+)+c(H+)= c(HSO3-) +2 c(SO32-)+c(OH-),故c项错误。
(3)①Cr2O72?具有强氧化性,能氧化SO2,离子方程式为:Cr2O72-+2H++3SO2=2Cr3++3SO42-+H2O
②CO32?与Cr3+发生水解反应,除了生成Cr(OH)3,另外生成的气体为CO2。
考点:本题考查化学方程式的书写、物质的性质、离子浓度比较、化学流程的分析。

“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭一面涂上一种特殊的涂料,该涂料的性质最可能的是 。
| A.在高温下不融化 | B.在高温下可分解气化 |
| C.在常温下就分解气化 | D.该涂料不可能发生分解 |
该反应中被氧化的原子与被还原的原子的物质的量之比是 。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
(3)如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,燃料电池放电时的负极反应为: 。如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为 mol。

(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。 已知该反应的阳极反应为:4OH—4e-=O2↑+2H2O 则阴极反应为: 。有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断上述反应是否能发生? 理由 。
(5).北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。
已知:①C3H8(g)
 CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1②CH3CH=CH2(g)
 CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1
CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1则相同条件下,反应C3H8(g)
 CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1 硫、氮、稀土元素的单质和化合物应用广泛。
Ⅰ.(1)将硫铁矿和焦炭放在炼硫炉中,在有限空气中燃烧,发生下列反应:
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
生成3mol硫时,被氧化的物质物质的量为__ _________。
(2)过硫酸钾化学式为:K2S2O8,过硫酸结构式为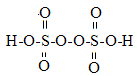
①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是 。
| A.CuO | B.MnO2 | C.Fe2O3 | D.NaNO3 |
③若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,由CeCl3·6H2O制备无水CeCl3应采取的措施是 _ _。