题目内容
【题目】实验是学习化学的一个重要途径。
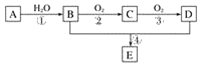
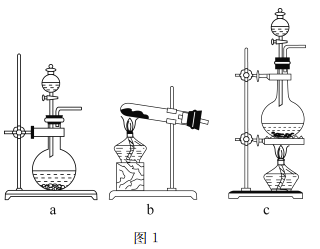
(1)图1是实验室常用的制气装置,其中b可用于制取O2和NH3,实验室用装置b制取NH3反应的化学方程式为______________________________________。若用二氧化锰和浓盐酸制取氯气应选择的装置为_______,反应的离子方程式为_____________________________。
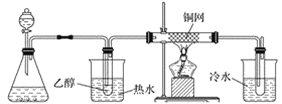
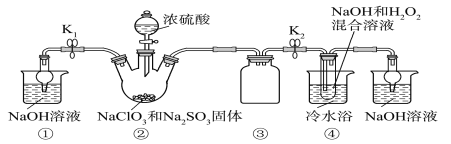
(2)图2是实验室制备氯气并进行一系列相关实验的装置。
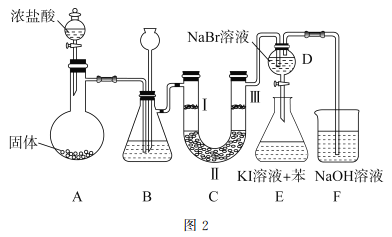
①装置B中盛装的液体试剂为_________。
②装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、II处依次放入的物质正确的是_________(填字母编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
③D中发生反应的离子方程式是_________。将装置D中的溶液加入装置E中,溶液分为两层,上层呈紫红色,要分离出紫红色溶液,需使用的玻璃仪器是玻璃棒、烧杯和________。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2OcMnO2+4H++2Cl-
CaCl2+2NH3↑+2H2OcMnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O饱和食盐水dCl2+2Br-=Br2+2Cl-分液漏斗
Cl2↑+Mn2++2H2O饱和食盐水dCl2+2Br-=Br2+2Cl-分液漏斗
【解析】
(1)由于b装置为“固+固![]() 气”型,则采用消石灰与氯化铵固体反应来制备,方程式为2NH4Cl+Ca(OH)2
气”型,则采用消石灰与氯化铵固体反应来制备,方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;二氧化锰和浓盐酸制取氯气需要加热,应选用装置c,离子方程式为: MnO2+4H++2Cl-
CaCl2+2NH3↑+2H2O;二氧化锰和浓盐酸制取氯气需要加热,应选用装置c,离子方程式为: MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O;(2)①用浓盐酸制取的Cl2中含有HCl,所以装置B中饱和食盐水的作用是除去Cl2中的HCl,故答案为:饱和食盐水;②为了验证氯气是否具有漂白性,I中加入湿润的有色布条,II为U型管,可加入固体干燥剂,得到干燥的Cl2,III中加入干燥的有色布条,即可证明Cl2是否具有漂白性,故答案为D;③Cl2通入D与NaBr反应生成Br2,则离子反应为:Cl2+2Br-=Br2+2Cl-,分离出E中两层液体的操作为分液,需要的玻璃仪器有烧杯和分液漏斗,故答案为:Cl2+2Br-=Br2+2Cl-、分液漏斗。
Cl2↑+Mn2++2H2O;(2)①用浓盐酸制取的Cl2中含有HCl,所以装置B中饱和食盐水的作用是除去Cl2中的HCl,故答案为:饱和食盐水;②为了验证氯气是否具有漂白性,I中加入湿润的有色布条,II为U型管,可加入固体干燥剂,得到干燥的Cl2,III中加入干燥的有色布条,即可证明Cl2是否具有漂白性,故答案为D;③Cl2通入D与NaBr反应生成Br2,则离子反应为:Cl2+2Br-=Br2+2Cl-,分离出E中两层液体的操作为分液,需要的玻璃仪器有烧杯和分液漏斗,故答案为:Cl2+2Br-=Br2+2Cl-、分液漏斗。