题目内容
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

回答下列问题:.
(1)固体1含有的物质是_________、CaCO3、Ca(OH)2;捕获剂所捕获的气体主要是_______________。
(2)若X是空气,则上述反应中NO和O2的物质的量之比最好为___________,若空气过量,导致的结果会是____________________________。
(3)流程中处理含NH4+废水时发生反应的离子方程式为____________________________。气体1也可通过催化剂直接转化成无污染气体,反应的化学方程式为_____________________________________。
(4)若工业废气中主要含N2、SO2,不考虑其他成分,则可用下列工艺生产NaHSO3过饱和溶液[NaHSO3过饱和溶液是生产焦亚硫酸钠(Na2S2O5)的原料]。
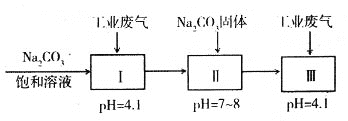
pH=4.1时,I中反应的化学方程式为_________________________;工艺中加入Na2CO3
固体、并再次通入废气的目的是_______________________________。
【答案】CaSO3 CO 4:1 NO将会被氧化成NaNO3,无法与NH4+反应生成无污染的N2 NH4++NO2-=N2↑+2H2O 2NO+2CO![]() N2+ 2CO2 Na2CO3+2SO2+H2O=2NaHSO3+CO2 加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液
N2+ 2CO2 Na2CO3+2SO2+H2O=2NaHSO3+CO2 加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液
【解析】
(1)石灰乳的成分为Ca(OH)2,能与CO2、SO2反应生成CaCO3、CaSO3,加入石灰乳过量,还有剩余的Ca(OH)2;NO被X气体氧化生成的NO2 被NaOH溶液吸收,所以气体2中被捕获剂捕获的气体主要为CO;综上所述,本题答案是:CaSO3,CO。
(2)根据反应流程可知,当反应物恰好完全反应生成了亚硝酸钠,二者配比为最佳配比;设NO为xmol、O2 ymol,根据电子得失守恒可知,x×(3-2)= y×2×2,所以x:y=4:1;若空气过量,NO将会被氧化而生成NaNO3,无法与废水中的NH4+反应生成无污染的N2;综上所述,本题答案是:4:1;NO将会被氧化而生成NaNO3,无法与NH4+反应生成无污染的N2。
(3) NH4+与亚硝酸根离子反应生成氮气,反应的离子方程式为:NH4++NO2-=N2↑+2H2O;气体1中含有NO、CO,通过催化剂直接转化成无污染气体氮气和二氧化碳,化学方程式为:2NO+2CO![]() N2+ 2CO2;综上所述,本题答案是:NH4++NO2-=N2↑+2H2O;2NO+2CO
N2+ 2CO2;综上所述,本题答案是:NH4++NO2-=N2↑+2H2O;2NO+2CO![]() N2+ 2CO2。
N2+ 2CO2。
(4)pH=4.1时,I中碳酸钠与二氧化硫反应生成亚硫酸氢钠和二氧化碳,反应的化学方程式为:Na2CO3+2SO2+H2O=2NaHSO3+CO2;工艺中加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液;综上所述,本题答案是:Na2CO3+2SO2+H2O=2NaHSO3+CO2;加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液。

【题目】实验是学习化学的一个重要途径。
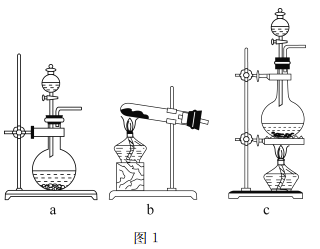
(1)图1是实验室常用的制气装置,其中b可用于制取O2和NH3,实验室用装置b制取NH3反应的化学方程式为______________________________________。若用二氧化锰和浓盐酸制取氯气应选择的装置为_______,反应的离子方程式为_____________________________。
(2)图2是实验室制备氯气并进行一系列相关实验的装置。
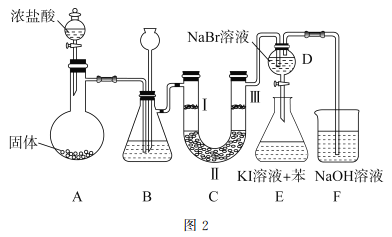
①装置B中盛装的液体试剂为_________。
②装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、II处依次放入的物质正确的是_________(填字母编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
③D中发生反应的离子方程式是_________。将装置D中的溶液加入装置E中,溶液分为两层,上层呈紫红色,要分离出紫红色溶液,需使用的玻璃仪器是玻璃棒、烧杯和________。
【题目】除去下列物质内所含的杂质(括号内的物质),所选用的试剂不正确的是 ( )
A.乙酸(苯甲酸):NaOH溶液B.甲烷(乙烯):溴水
C.苯(苯甲酸):NaOH溶液D.乙炔(硫化氢):亚硫酸钠酸性溶液
【题目】某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应
A(s)+2B(g) ![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T 1 ℃时,该反应的平衡常数K=________。
(2)30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2 mol B、0.1 mol D、0.1 mol E
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的________(填序号)。

(4)维持容器的体积和温度T1 ℃不变,若向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和n mol A,达到平衡后,与表格中20分钟时各物质的浓度完全相同,则投入固体A的物质的量n的取值范围是________。
(5)维持容器的体积和温度T1 ℃不变,各物质的起始物质的量为:n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,n(E)=0 mol,达到平衡后,n(E)=0.50 mol,则a=________。
(6)若该密闭容器绝热,实验测得B的转化率B% 随温度变化的示意图如图2所示。由图可知,Q_______0(填“大于”或“小于”),c点v正_______v逆(填“大于”、“小于”或“等于”)。