题目内容
【题目】利用钒钛磁铁矿冶炼后产生的钒渣(主要含FeO·V2O3、Al2O3、SiO2及少量可溶性磷酸盐)生产V2O5的工艺流程如下,回答下列问题:
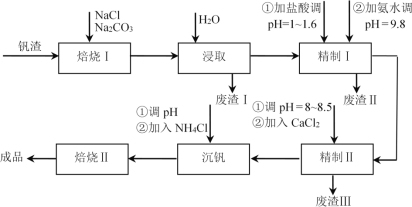
已知:①V2O5、Al2O3、SiO2可与Na2CO3、NaCl组成的混合钠盐在高温下反应,并转化为NaVO3、NaAlO2、Na2SiO3等可溶性钠盐。
②AlO![]() +4H+=Al3++2H2O。
+4H+=Al3++2H2O。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得V2O5,写出氧化过程中FeO·V2O3发生反应的化学方程式________;废渣Ⅰ的主要成分是________;精制Ⅰ中加盐酸调pH的主要作用是________,加入NH3·H2O后发生反应的离子方程式为________。
(2)精制Ⅱ中加入CaCl2溶液除去磷酸盐,pH过小时影响除磷效果的原因是________;pH过大时,沉淀量增大的原因是________。
(3)沉钒所得NH4VO3沉淀需进行洗涤,洗涤时除去的阴离子主要是________。NH4VO3在500℃时焙烧脱氨制得产品V2O5,反应方程式为2NH4VO3![]() V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
V2O5+H2O↑+2NH3↑。但脱氨过程中,部分V2O5会转化成V2O4,反应中氧化剂与还原剂物质的量之比为3:2,该反应的化学方程式为________。
【答案】4FeO·V2O3 + 5O2 ![]() 2Fe2O3 + 4V2O5 Fe2O3 [或Fe(OH)3] 除Si并转化AlO2-写“除Si”即得分) Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH H+ + NH3·H2O = H2O + NH(写出第一个离子方程式即得分) 形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙和/或磷酸二氢钙) 产生了Ca(OH)2沉淀 Cl- 3V2O5 + 2NH3
2Fe2O3 + 4V2O5 Fe2O3 [或Fe(OH)3] 除Si并转化AlO2-写“除Si”即得分) Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH H+ + NH3·H2O = H2O + NH(写出第一个离子方程式即得分) 形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙和/或磷酸二氢钙) 产生了Ca(OH)2沉淀 Cl- 3V2O5 + 2NH3![]() 3V2O4 + N2 + 3H2O
3V2O4 + N2 + 3H2O
【解析】
氧化过程FeO·V2O3生成对应的金属氧化物Fe2O3和V2O5;经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3[或Fe(OH)3]成为滤渣;精制Ⅰ中加盐酸调pH为了和SiO32-反应生成硅酸沉淀,将AlO2-转化为Al3+;加入NH3·H2O后与Al3+发生反应生成Al(OH)3沉淀;精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,沉钒时加入试剂NH4Cl,所得NH4VO3沉淀,焙烧得到产品,据此分析。
(1)氧化过程FeO·V2O3生成对应的金属氧化物Fe2O3和V2O5,化学方程式为:4FeO·V2O3 + 5O2![]() 2Fe2O3 + 4V2O5;经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3 [或Fe(OH)3]成为滤渣;精制Ⅰ中加盐酸调pH为了和SiO32-反应生成硅酸沉淀,将AlO2-转化为Al3+;加入NH3·H2O后与Al3+发生反应生成Al(OH)3沉淀,还可以中和酸,反应方程式为:
2Fe2O3 + 4V2O5;经过氧化和钠化后,V2O5、Al2O3、SiO2均转化为可溶性盐,Fe2O3 [或Fe(OH)3]成为滤渣;精制Ⅰ中加盐酸调pH为了和SiO32-反应生成硅酸沉淀,将AlO2-转化为Al3+;加入NH3·H2O后与Al3+发生反应生成Al(OH)3沉淀,还可以中和酸,反应方程式为:![]() 、
、![]() ,故答案为:4FeO·V2O3 + 5O2
,故答案为:4FeO·V2O3 + 5O2 ![]() 2Fe2O3 + 4V2O5;Fe2O3 [或Fe(OH)3];除Si并转化AlO2-(写“除Si”即得分);
2Fe2O3 + 4V2O5;Fe2O3 [或Fe(OH)3];除Si并转化AlO2-(写“除Si”即得分);![]() ,
,![]() (写出第一个离子方程式即得分);
(写出第一个离子方程式即得分);
(2)精制Ⅱ中加入CaCl2溶液生成磷酸钙沉淀,除去磷酸盐,pH过小时形成溶解度较大的酸式盐;pH过大时易形成Ca(OH)2沉淀,故答案为:形成溶解度较大的酸式盐(或形成溶解度较大的磷酸氢钙和/或磷酸二氢钙);产生了Ca(OH)2沉淀;
(3)沉钒时加入试剂NH4Cl,因此所得NH4VO3沉淀含有阴离子主要为Cl-;脱氨过程中,部分V2O5会转化成V2O4,且反应中氧化剂与还原剂物质的量之比为3:2,则V2O5为氧化剂,NH3为还原剂,还原产物为V2O4,氧化产物为N2,则氧化还原方程式为:3V2O5 + 2NH3 ![]() 3V2O4 + N2 + 3H2O,故答案为:Cl-;3V2O5 + 2NH3
3V2O4 + N2 + 3H2O,故答案为:Cl-;3V2O5 + 2NH3 ![]() 3V2O4 + N2 + 3H2O。
3V2O4 + N2 + 3H2O。