题目内容
【题目】已知A、B、C、D为气体,其中A为黄绿色气体。E、F为固体且均含三种元素,G是氯化钙,它们之间的转换关系如下图所示:
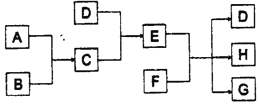
(1)D的化学式是__________________________。
(2)H的电子式为__________________________。
(3)A和B反应生成C的化学方程式是__________________________。
(4)将A通入F的澄清溶液中所发生反应的离子方程式是__________________________。
【答案】 NH3 ![]() H2+Cl2
H2+Cl2![]() 2HC1 Cl2+2OH-=Cl-+ClO-+H2O
2HC1 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
框图推断题的关键是找准切入点,由A 为黄绿色气体知A为氯气,由题目提示知A、B、C、D为气体, E、F为固体,由D+C―→E可知E为铵盐,再由E+F―→D知D为氨气,且F为碱,又知“G为氯化钙”推出F为Ca(OH)2,C为HCl气体。H为水。所以
(1)D 的化学式是:NH3
(2)H 的电子式为![]()
(3)A 和B 反应生成C 的化学方程式是:H2+Cl2![]() 2HC1
2HC1
(4)将A 通入F 的澄清溶液中所发生反应的离子方程式是:Cl2+2OH-=Cl-+ClO-+H2O

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应: ![]() H=-213.5kJ/mol,达到平衡时的数据如下:
H=-213.5kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是
A. 上述信息可推知:T12
B. T1℃时,该反应的平衡常数K=9/16
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
【题目】研究氮的氧化物具有重要意义。回答下列问题:
(1)2016年10月19日“天宫二号”与“神舟十一号”顺利实现太空交会对接。运载火箭用的是一种叫肼(N2H4)的燃料和氧化剂NO2,两者反应生成氮气和气态水。
已知: N2 (g) + 2O2 (g) = 2NO2 (g) △H = +67.7 kJ·mol-1
N2 H4 (g) +O2 (g) = N2 (g) +2H2 O (g) △H =-543 kJ·mol-1
①写出肼和NO2反应的热化学方程式__________________________________。
②若已知: 2H2(g)+O2(g)=2H2O(g) ΔH1=-Q1 kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH2=-Q2 kJ·mol-1,
则 Q1_________Q2(填“>”“<”或“=”)。
(2)汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定条件下,在三个体积均为1.0 L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定条件下,在三个体积均为1.0 L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 |
| 0.12 |
II | 400 | 0.4 | 0.4 | 0 | 0 |
| x |
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 |
|
①容器I中达到平衡所需时间2 s,则v(N2)=_______;
②x_____0.24(填“>”、“=”、“<”);△H_____0 (填“>”、“=”、“<”);
③若起始时向I中充入NO、CO各0.1 mol,N2、CO2各0.0 5 mol,开始时v(正)
___ v(逆) (填“>”、“=”、“<”)。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
①SCR(选择性催化还原)工作原理:
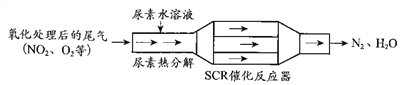
尿素溶液浓度影响NO2的转化,控制尿素的浓度非常关键。测定溶液中尿素(M=60 g·mol 1)含量的方法如下:取a g尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用V2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________________________。
②NSR(NOx储存还原)工作原理:
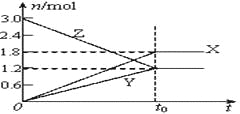
NOx的储存和还原在不同时段交替进行,如图a所示。

通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_______;
用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是__________。