题目内容
已知H-H、Cl-Cl和H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1,请用此数据估计,由Cl2、H2生成2mol H-Cl 时的热效应△H等于( )
| A.-183 kJ·mol-1 | B.-91.5kJ·mol-1 |
| C.+183kJ·mol-1 | D.+ 91.5kJ·mol-1 |
A
解析试题分析:H-H的键能为436kJ?mol-1、Cl-Cl键能为243kJ?mol-1、H-Cl键能为431kJ?mol-1,
由于反应热=反应物总键能-生成物总键能,则:Cl2(g)+H2(g)=2HCl(g)热效应△H=436kJ?mol-1+243kJ?mol-1-2×431kJ?mol-1=-183 kJ?mol-1。
考点:有关反应热的计算

 考前必练系列答案
考前必练系列答案镁粉与碘粉均匀混合,滴加几滴水,发生剧烈反应,并产生大量紫色蒸气。以下叙述错误的是
| A.H2O作催化剂 | B.紫色蒸气是I2 |
| C.该反应是放热反应 | D.反应后物质的总能量升高 |
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+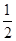 O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法错误的是
| A.CO的燃烧热为283 kJ/mol |
B.下图可表示由CO生成CO2的反应过程和能量关系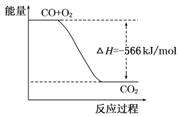 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
已知在25℃时:
①2C(石墨)+O2(g)=2CO(g) △H1=-222kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
③C(石墨)+O2(g)=CO2 △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为:
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+41kJ/mol |
已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-Q1 ①
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 ②
H2O(g)=H2O(l) ΔH=-Q3 ③
常温下,取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为( )
| A.4Q1+0.5Q2 | B.4Q1+Q2+10Q3 | C.4Q1+0.5Q2+9Q3 | D.4Q1+2Q2 |
下列既是氧化还原反应,又是吸热反应的是( )
| A.葡萄糖在人体内氧化 |
| B.锌粒与稀H2SO4反应制取H2 |
| C.Ba(OH) 2·8H2O与NH4Cl反应 |
| D.二氧化碳与赤热的炭反应生成一氧化碳 |
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=+906 kJ·mol-1 |
