题目内容
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3 |
| B.H2的燃烧热为241.8 kJ·mol-1 |
| C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
| D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)ΔH=+906 kJ·mol-1 |
C
解析试题分析:A、 ,错误;B、
,错误;B、 在25℃,101 kPa时是液态,不是气态,1mol可燃物完全燃烧必须生成液态水时放出的热量才能称为燃烧热,气态水不可以,错误;C、再次通入气体,会使容器内的压强增大,平衡会向体积减少的方向移动,所以184.8>Q2>2Q1,正确;D、氨的催化氧化反应为4NH3(g) +5O2(g)
在25℃,101 kPa时是液态,不是气态,1mol可燃物完全燃烧必须生成液态水时放出的热量才能称为燃烧热,气态水不可以,错误;C、再次通入气体,会使容器内的压强增大,平衡会向体积减少的方向移动,所以184.8>Q2>2Q1,正确;D、氨的催化氧化反应为4NH3(g) +5O2(g) 4NO(g)+6H2O(g) △H="-1025" kJ/mol,错误。
4NO(g)+6H2O(g) △H="-1025" kJ/mol,错误。
考点:化学反应的能量变化。

根据以下三个热化学反应方程式:2H2S(g)+3O2(g) =2SO2(g)+2H2O(l)  H= -Q1 kJ/mol;
H= -Q1 kJ/mol;
2H2S(g)+O2(g) =2S(s) +2H2O(l)  H= -Q2kJ/mol;
H= -Q2kJ/mol;
2H2S(g)+O2(g) =2S(s)+2H2O(g)  H= -Q3kJ/mol。
H= -Q3kJ/mol。
判断Q1、Q2、Q3三者关系正确的是
| A.Q1>Q2>Q3 | B.Q1>Q3>Q2 | C.Q3>Q2>Q1 | D.Q2>Q1>Q3 |
已知H-H、Cl-Cl和H-Cl的键能分别为436 kJ·mol-1、243 kJ·mol-1和431 kJ·mol-1,请用此数据估计,由Cl2、H2生成2mol H-Cl 时的热效应△H等于( )
| A.-183 kJ·mol-1 | B.-91.5kJ·mol-1 |
| C.+183kJ·mol-1 | D.+ 91.5kJ·mol-1 |
下列说法或表示方法正确的是( )
| A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
B.由C(石墨) C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 C(金刚石) ΔH="+1.9" KJ/mol可知,金刚石比石墨稳定 |
| C.1mol H2在足量Cl2中燃烧放热183KJ,则H2的燃烧热为183KJ。 |
| D.在稀溶液中,H+(aq)+OH-(aq)==H2O(l)ΔH="-57.3" kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ |
已知化学键能:Si—Si:M KJ/mol O=O:N KJ/mol Si—O:Q KJ/mol,则Si (s) + O2 (g) =SiO2 (s); ΔH=( )
| A.—(4Q—2M—N)KJ/mol | B.—(4Q—M—2N)KJ/mol |
| C.—(2Q—M—2N)KJ/mol | D.—(2Q—2M—N)KJ/mol |
已知下列热化学方程式,则③中的Q3值为
Zn(s)+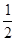 O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
O2(g)= ZnO (s) △H=" -" Q1 kJ? mol-1 ①
Hg(l) +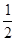 O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
O2(g)= HgO (s) △H= -Q2 kJ? mol-1 ②
Zn(s) +HgO (s) = Hg(l)+ ZnO (s) △H= -Q3 kJ? mol-1 ③
| A.Q2 -Q1 | B.Q1 +Q2 | C.Q1- Q2 | D.-Q1- Q2 |
今有如下三个热化学方程式:
H2(g)+ O2(g)=H2O(g);△H=" a" kJ/mol
O2(g)=H2O(g);△H=" a" kJ/mol
H2(g)+ O2(g)=H2O(l);△H=" b" kJ/mol
O2(g)=H2O(l);△H=" b" kJ/mol
2H2(g)+ O2(g)=2H2O(l);△H=" c" kJ/mol
关于它们的下列表述,正确的是
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.反应热的关系:a=b | D.反应热的关系:2b=c |
已知下列热化学方程式:
Zn(s)+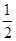 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
Hg(l)+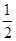 O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l) ΔH3,其中ΔH3的值是 ( )
| A.-441.8 kJ·mol-1 | B.-254.6 kJ·mol-1 |
| C.-438.9 kJ·mol-1 | D.-260.4 kJ·mol-1 |
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是( )
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |