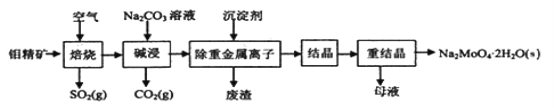
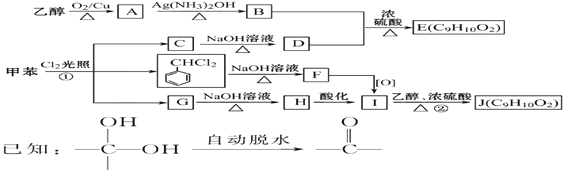
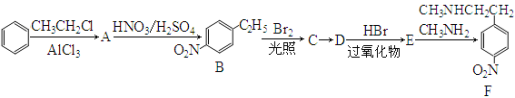
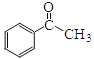
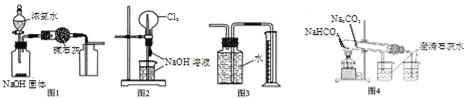题目内容
【题目】过渡元素Ti、Mn、Fe、Cu等可与C、H、O形成多种化合物。请回答下列问题:
(1)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Mn属于________区。某一次性电池负极材料是Zn,正极材料是Mn的一种常见氧化物,放电后生成MnOOH,电解质是KOH。该电池的正极反应式为__________________________。
(2)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。基态Ti2+中电子占据的最高能层符号为________,该能层具有的原子轨道数为________。BH4-的立体构型是________。
(3)单质Cu的晶体类型为______,晶体中组成微粒通过________作用形成面心立方密堆积,其中Cu原子的配位数为______。在Cu的催化作用下,乙醇可被空气中氧气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中∠HCO的键角________乙醇分子中∠HCO的键角(填“大于”、“等于”或“小于”)。
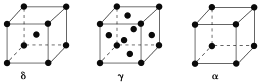
(4)单质铁有δ、γ、α三种同素异形体,三种晶胞中Fe原子的配位数之比为________,δ、γ、α三种晶胞的边长之比为________。
【答案】 d MnO2+e-+H2O=MnOOH+OH- M 9 正四面体型 金属晶体 金属键 12 sp2、sp3 大于 4∶6∶3 ![]() ∶
∶![]() ∶1
∶1
【解析】(1)Mn为第ⅤⅢ族元素, 核外电子排布1s22S22p63s23p63d54s2,最后填充电子为d电子,则位于d区;正极材料为二氧化锰,得电子,发生还原反应,生成MnOOH,该电池的正极反应式为MnO2+e-+H2O=MnOOH+OH-;正确答案:d;MnO2+e-+H2O=MnOOH+OH-。
(2)钛原子核电荷数为22,核外电子排布1s22S22p63s23p63d24s2,基态Ti2+价电子排布式为3d2,最高能层为M层;该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;。BH4-中B原子价层电子对4+1/2(3+1-4×1)=4,且没有孤电子对,属于sp3杂化,为正四面体型;正确答案:M;9;正四面体型。
(3) Cu属于金属,因此单质Cu为金属晶体;晶体中铜离子和自由电子之间通过金属键作用成面心立方密堆积,每个晶胞中铜原子个数8×1/8+6×1/2=4,在铜的晶胞中,顶点上的铜原子被8个晶胞占有,每个晶胞中与一个顶点上铜原子距离最近的铜原子数是3,每个面上的铜原子被2个晶胞占有,所以其配位数是3×8×1/2=12,所以Cu原子的配位数为12;乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用 sp3杂化;醛基中的碳原子采用 sp2杂化;醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3 杂化,导致乙醛分子中∠HCO的键角大于乙醇分子中的∠HCO的键角;正确答案:金属晶体;金属键;12;sp2、sp3 ; 大于。
(4)δ-Fe为体心立方密堆积,配位数为8;γ-Fe为面心立方密堆积,配位数为12;α-Fe为简单立方堆积,配位数为6;则δ、γ、α三种晶胞中铁原子的配位数之比为:8:12:6=4∶6∶3;设原子半径为r, δ中体对角线为4r,若设棱长为x,则x2+(![]() x)2=(4r)2,计算得出x=4r/
x)2=(4r)2,计算得出x=4r/![]() ;γ中面对角线为4r,若设棱长为y,则y2+y2=(4r)2,计算得出y=2
;γ中面对角线为4r,若设棱长为y,则y2+y2=(4r)2,计算得出y=2![]() r;α中棱长为2r;则三种晶胞中棱长之比为: 4r/
r;α中棱长为2r;则三种晶胞中棱长之比为: 4r/![]() : 2
: 2![]() r: 2r =
r: 2r =![]() ∶
∶![]() ∶1;正确答案:4∶6∶3;
∶1;正确答案:4∶6∶3;![]() ∶
∶![]() ∶1。
∶1。