题目内容
20.为了测定含氰废水中CN-的含量,某化学小组利用图1所示装置进行实验.关闭活塞a,将100mL含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应后,打开活塞b,滴入稀H2SO4溶液,然后关闭活塞b.
已知装置B中发生的主要反应为:
CN-+ClO-═CNO-+Cl-
2CNO?+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
副反应为:Cl-+ClO-+2H+=C12↑+H2O
(1)装置D的作用是防止空气中的CO2和水蒸气进入C装置.
(2)反应过程中,装置C中的实验现象为有白色沉淀生成,溶液的红色逐渐褪色.
(3)待装置B中的反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收
(4)反应结束后,装置C中生成39.4mg沉淀,则废水中c(CN-)=0.002mol•L-1.
(5)对上述实验装置进行合理改进,可通过直接测量装置C反应前后的质量变化,测定废水中CN-的含量.设计合理实验方案在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶.
仪器自选.
供选的试剂:浓硫酸、NaOH溶液、饱和食盐水、饱和NaHCO3溶液、CCl4.
(6)利用图2所示装置可以除去废水中的CN-.控制溶液pH为5.2~6.8时,CN-转化为 C2O42-和NH4+.
①NH4+的电子式
 .
.②气体a的化学式为H2.
④阳极的电极反应式为2CN-+4H2O-2e-=C2O42-+2NH4+.
分析 (1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定C装置的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去;
(3)反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O,结合定量关系计算;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置;
(6)NH4+是多原子构成的阳离子,电子式要加中括号和电荷;利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气.
解答 解:(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,
故答案为:防止空气中的CO2和水蒸气进入C装置;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,
故答案为:有白色沉淀生成,溶液的红色逐渐褪色;
(3)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置C并被Ba(OH)2完全吸收,以减少实验误差,
故答案为:将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成39.4mg沉淀为BaCO3↓物质的量=$\frac{39.4×1{0}^{-3}g}{197g/mol}$=2×10-4mol
CN-+~CNO-~CO2~BaCO3↓
1 1
c(CN-)=$\frac{2×1{0}^{-4}mol}{0.1L}$=0.002mol/L,
故答案为:0.002;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置,在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶,
故答案为:在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶;
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气;
①NH4+是多原子构成的阳离子,电子式要加中括号和电荷,其电子式为: ,
,
故答案为: ;
;
②分析可知气体a是阴极上氢离子得到电子生成的氢气,
故答案为:H2;
③在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,电极反应为:2CN-+4H2O-2e-=C2O42-+2NH4+,
故答案为:2CN-+4H2O-2e-=C2O42-+2NH4+.
点评 本题综合考查物质含量的测定的实验设计,以氯气的性质为载体考查化学实验设计和评价问题,题目难度中等,注意把握实验原理和实验方法.

| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
| A. | 泡沫灭火器内分别装有硫酸铝、碳酸钠溶液以及发泡剂 | |
| B. | 明巩既可用做净水剂,也可用作消毒剂 | |
| C. | PM2.5是指直径大于2.5微米的颗粒污染物 | |
| D. | 维生素C具有还原性,可用作食品抗氧化剂 |
| A. | c(OH 一)>c(H +)时,a=b | B. | c(K +)>c(CH 3COO -)时,a>b | ||
| C. | c(OH 一)=c(H +)时,a>b | D. | c(K +)<c(CH 3COO-)时,a<b |
| A. | 当消耗CH3COOH的速率与消耗H2O2的速率相等时,反应达到限度 | |
| B. | 达反应限度时,CH3COOH、H2O2、CH3COOOH的浓度均不再变化 | |
| C. | 达反应限度时,CH3COOH不再与H2O2发生反应 | |
| D. | 若在反应中适当降低CH3COOH浓度,可提高反应速率 |
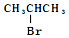 为原料制取
为原料制取  ,需要经过的反应为( )
,需要经过的反应为( )| A. | 加成--消去--取代 | B. | 消去--加成--取代 | ||
| C. | 消去--取代--加成 | D. | 取代--消去--加成 |
 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白: