题目内容
12.常温下amo1/L CH 3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定错误的是( )| A. | c(OH 一)>c(H +)时,a=b | B. | c(K +)>c(CH 3COO -)时,a>b | ||
| C. | c(OH 一)=c(H +)时,a>b | D. | c(K +)<c(CH 3COO-)时,a<b |
分析 若a=b,等体积混合生成醋酸钾,水解显碱性,a<b时KOH过量,a>b时醋酸过量,以此来解答.
解答 解:A.若a=b,等体积混合生成醋酸钾,水解显碱性,则c(OH -)>c(H +),或a<b时KOH过量,故A正确;
B.c(K +)>c(CH 3COO- )时,且a>b时醋酸过量,为醋酸、醋酸钾的混合溶液,若水解大于电离,符合题意,故B正确;
C.a>b时醋酸过量,为醋酸、醋酸钾的混合溶液,若醋酸电离程度等于醋酸根离子水解程度,则溶液为中性,c(OH -)=c(H +),故C正确;
D.c(K +)<c(CH 3COO- )时,必须醋酸过量,则应满足a>b,故D错误;
故选D.
点评 本题考查酸碱混合及离子浓度比较,为高频考点,把握混合后溶液的溶质、电离与水解的应用为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度较大.

练习册系列答案
相关题目
3.常温时,下列溶液中各粒子的浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的KOH溶液等体积混合:c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHC2O4溶液,其pH=4:c(HC2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) | |
| C. | 醋酸钠和醋酸的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol/L的NaHSO3溶液中:c(H+)+c(H2SO3)=c(SO32-)+c(OH-) |
7.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | “时气错逆,霾雾蔽日”,雾所形成的气溶胶能产生丁达尔效应 | |
| B. | “青蒿一揭,以水二升溃,绞取汁”,屠呦呦提取青蒿素的过程中发生了化学变化 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,北宋沈括用胆矾炼铜的过程属于置换反应 | |
| D. | “外观如雪,强烧之,紫青烟起”,南北朝陶弘景对硝酸钾的鉴定过程中利用了焰色反应 |
17.下列说法不正确的是( )
| A. | 多糖和蛋白质都是高分子化合物 | |
| B. | 淀粉和纤维素分子式相同、结构不同,二者互为同分异构体 | |
| C. | 蛋白质和多糖在一定条件下都能发生水解反应 | |
| D. | 蛋白质具有酸碱两性 |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 10mL18mol/L浓硫酸与足量铜加热充分反应,转移电子数为0.18NA | |
| B. | 11gT2O超重水中含有的中子数为5NA | |
| C. | 标准状况下,22.4LCO2中含有的共用电子对数为2NA | |
| D. | 7.8 gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA |

 .
.

 )可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常
)可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等.以下是屈昔多巴的一种合成路线(通常 简写为BnCl,
简写为BnCl, 简写为CbzCl ):
简写为CbzCl ):
 显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
显碱性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:
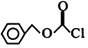 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有6种,其中核磁共振氢谱为四组峰的结构简式为 (任写一种).
(任写一种). .
.