题目内容
【题目】一定温度下,将0.6 mol A和0.5 mol B充入0.4 L密闭容器中发生2A(g)+B(g)![]() mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
mD(g)+E(g),经过5 min后达到化学平衡,此时测得D为0.2 mol。又知5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是( )
A. A、B均转化了20% B. m值为2
C. 该温度下,反应的平衡常数K为1.33L·mol-1 D. 平衡时混合物总物质的量为1 mol
【答案】C
【解析】5 min内用E表示的平均反应速率为0.1 mol·L-1·min-1,说明生成的E为0.5 mol·L-1,物质的量为0.5×0.4=0.2mol,则生成的D、E相等,所以m=1选项B错误。生成0.2molE,一定消耗了0.4molA和0.2molB,所以A的转化率为2/3,选项A错误。达平衡时c(A)=0.5mol/L,c(B)=3/4mol/L,c(D)=0.5mol/L,c(E)=0.5mol/L,所以K=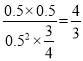 ,即1.33L·mol-1,选项C正确。平衡时A、B、D、E分别为0.2mol、0.3mol、0.2mol和0.2mol,总物质的量为0.9mol,选项D错误。
,即1.33L·mol-1,选项C正确。平衡时A、B、D、E分别为0.2mol、0.3mol、0.2mol和0.2mol,总物质的量为0.9mol,选项D错误。

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目