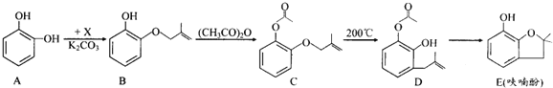
题目内容
【题目】某溶液中可能含有H+、NH4+、Fe3+、CO32-、SO42-、NO3-中的几种,且各种离子浓度相等。加入铝片,产生H2。下列说法正确的是
A. 向原溶液中加入Cu片发生:3Cu+8H++2NO3-=3Cu2++4H20+2NO↑
B. 向原溶液中加入过量氨水发生:Fe3++H++4NH3·H2O=Fe(OH)3↓+4NH4+
C. 向原溶液中加入过量Ba(OH)2溶液发生:Ba2++20H-+SO42-+NH4++H+=NH3·H2O +BaSO4↓+H2O
D. 向原溶液中加入BaCl2溶液发生:2Ba2++CO32-+SO42-=BaCO3↓+BaSO4↓
【答案】C
【解析】因碱性条件,H+、![]() 、Fe3+均不存在,所以为酸性条件;加入铝片,产生H2,不可能存在
、Fe3+均不存在,所以为酸性条件;加入铝片,产生H2,不可能存在![]() 和
和![]() ,则存在H+、
,则存在H+、![]() 、Fe3+、
、Fe3+、![]() ,但因各种离子浓度相等,根据电荷守恒,则不存在Fe3+,所以原溶液中存在H+、
,但因各种离子浓度相等,根据电荷守恒,则不存在Fe3+,所以原溶液中存在H+、![]() 、
、![]() ;据以上分析解答。
;据以上分析解答。
因碱性条件,H+、![]() 、Fe3+均不存在,所以为酸性条件;加入铝片,产生H2,不可能存在
、Fe3+均不存在,所以为酸性条件;加入铝片,产生H2,不可能存在![]() 和
和![]() ,则存在H+、
,则存在H+、![]() 、Fe3+、
、Fe3+、![]() ,但因各种离子浓度相等,根据电荷守恒,则不存在Fe3+,所以原溶液中存在H+、
,但因各种离子浓度相等,根据电荷守恒,则不存在Fe3+,所以原溶液中存在H+、![]() 、
、![]() 。A.向原溶液中加入Cu片,无
。A.向原溶液中加入Cu片,无![]() 存在,反应不可能发生,A错误;B. 向原溶液中加入过量氨水,NH3·H2O与H+反应,无Fe3+存在,反应不可能发生,B错误;C.向原溶液中加入过量Ba(OH)2溶液发生:Ba2++2OH-+
存在,反应不可能发生,A错误;B. 向原溶液中加入过量氨水,NH3·H2O与H+反应,无Fe3+存在,反应不可能发生,B错误;C.向原溶液中加入过量Ba(OH)2溶液发生:Ba2++2OH-+![]() +
+![]() +H+=NH3·H2O+BaSO4↓+H2O,C正确;D.向原溶液中加入BaCl2溶液,原溶液中无
+H+=NH3·H2O+BaSO4↓+H2O,C正确;D.向原溶液中加入BaCl2溶液,原溶液中无![]() ,D错误;正确答案C 。
,D错误;正确答案C 。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】工业上以CO为原料生产二甲醚的反应为:3H2(g)+3CO(g) ![]() CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
CH3OCH3(g)+CO2(g) △H=a kJmol-1 T℃时,起始时在恒容密闭容器中加入一定量的H2和CO,实验内容和结果如下表和下图所示。
实验 序号 | 容器 体积 | 起始物质的量 | 达平衡时 放出热量 | |
H2 | CO | |||
Ⅰ | 2L | 8mol | 8mol | 494 kJ |
Ⅱ | 2L | 4mol | 4mol | —— |

(1)上述反应平衡常数K的表达式为_____。
(2)由题意可知,a=______,b________1(填“>”、“<”或“=”)。
(3)实验Ⅰ中,反应前10 min内的平均速率v(H2)=_____。
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是______ (填写序号字母)。
a.及时分离出CH3OCH3气体b.保持容器的容积不变,再充入1 mol CO和1 mol H2
c.适当升高温度 d.保持容器的容积不变,充入1 mol 氦气
(5)T℃时,若容器中含1 molL-1 H2、2 molL-1 CO、2 molL-1 CH3OCH3、3 molL-1 CO2,则此时v正________v逆(填“>”、“<”或“=”)。